
【题目】依据事实,回答下列问题。
(1)在 25℃、101 kPa 时,1.0 g C8H18(l,辛烷)燃烧生成CO2(g)和H2O(l),放出48.40kJ的热量,则C8H18(l)的燃烧热为_____kJ/mol
(2)已知N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol,N2H4(g)+O2(g)= N2(g)+2H2O (g) ΔH=-534kJ/mol,根据盖斯定律写出肼(N2H4)与 NO2完全反应生成氮气和气态水的热化学方程式____________。
(3)某反应过程中的能量变化如图所示,则该反应是___________反应(填“放热”或“吸热”),判断依据是____________________。

(4)已知:2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJmol-1
N2(g)![]() 2N(g)
2N(g)
Cl2(g)![]() 2Cl(g)
2Cl(g)
则断开1 mol H–N键与断开1 mol H-Cl键所需能量相差约为_____kJ。
【答案】5517.6 2N2H4(g)+2NO2 (g) = 3N2(g)+4H2O(g) △H=-1135.7kJ/mol 吸热 反应物总能量小于生成物总能量 41
【解析】
(1)燃烧热限定可燃物为1mol,1mol 辛烷质量为114g,所以燃烧热应为48.40的114倍。
(2)首先写出方程式2N2H4(g)+2NO2(g) = 3N2(g)+4 H2O(g),再根据盖斯定律求算焓变。
(3)由反应物与生成物的能量大小,可确定反应是吸热还是放热。
(4)△H=反应物的总键能-生成物的总键能,代入数据即可求出断开 1 mol H–N键与断开1 mol H–Cl键所需能量的差值。
(1) 1mol 辛烷质量为 114g,所以燃烧热应为48.40kJ/mol×114=5517.6 kJ/mol。答案为:5517.6;
(2) N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol ①
N2H4(g)+O2(g)= N2(g)+2H2O (g) ΔH=-534kJ/mol ②
反应方程式为2N2H4(g)+2NO2(g) = 3N2(g)+4H2O(g),依据盖斯定律,将②×2-①,即得肼(N2H4)与NO2完全反应生成氮气和气态水的热化学方程式为2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=-1135.7kJ/mol。答案为:2N2H4(g)+2NO2(g) = 3N2(g)+4H2O(g) △H=-1135.7kJ/mol;
(3)由于反应物的总能量<生成物的总能量,所以反应吸热;判断依据是反应物总能量小于生成物总能量。答案为:吸热;反应物总能量小于生成物总能量;
(4) △H=反应物的总键能-生成物的总键能=6×E(N-H)+3×E(Cl-Cl)-E(N≡N)-6×E(H-Cl)= -462 kJmol-1,6×[E(N-H) –E(H-Cl)]=-246 kJmol-1,所以断开 1 mol H–N键与断开1 mol H–Cl 键所需能量相差约为41 kJ。答案为:41 kJ。


科目:高中化学 来源: 题型:
【题目】黄铜是由铜和锌组成的合金,在黄铜中加入镍可显著提高黄铜在大气中和海水中的耐蚀性。回答下列问题:
(1)基态Ni2+的核外电子排布式为____________________,有_______个未成对电子。
(2)CuSO4溶液里逐滴滴入过量氨水,形成深蓝色溶液。
①深蓝色的溶液 是因为生成了一种配离子,其离子符号为____________________
其中配位原子是____________ 。
②NH3分子的空间构型是_______。NH3的键角______(填大于或小于)H2O,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学发展是旧理论不断被质疑、被打破的过程。苯曾被认为是“环己三烯”的结构,后经修正成为我们今天所学的理论。如图列举了几种常见的环状多烯结构,下列说法正确的是( )
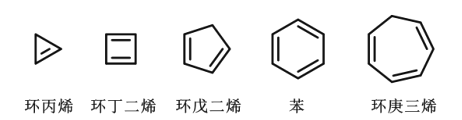
A.环丙烯、环丁二烯和环戊二烯均可分别实现所有碳原子共平面
B.上述五种化合物均可使溴的四氯化碳溶液褪色
C.上述五种化合物互为同系物,化学性质相似
D.依照上述环状多烯的结构规律,可以推测“环辛四烯”的分子式为C8H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CaCO3溶于CH3COOH溶液中,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
B.向AlCl3溶液中通入过量NH3,反应的离子方程式为:Al3++4OH-=![]() +2H2O
+2H2O
C.下列四种离子因发生氧化还原反应而不能大量共存:K+、Fe3+、SCN-、Cl-
D.向稀硫酸中滴入Ba(OH)2溶液,反应的离子方程式为:Ba2++2OH-+2H++![]() =2H2O+BaSO4↓
=2H2O+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况(不计CO2的溶解),则下列对应图形的判断正确的是
A. 含有两种溶质 B. 只含有一种溶质
B. 只含有一种溶质 C. 只含有碳酸钠
C. 只含有碳酸钠 D. 有碳酸钠和碳酸氢钠
D. 有碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B. 少量SO2通入氢氧化钠溶液中:OH-+SO2=HSO3-
C. 加热可增强纯碱溶液去污能力:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. 用惰性电极电解CuSO4溶液: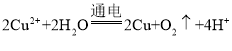
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家用氮化鎵材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2下列有关说法中正确的是( )
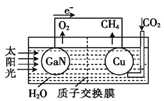
A. 该装置只有化学能转化为电能
B. 氮化镓电极是阴极
C. 导线中经过2mol的电子,氮化镓电极生成lmol O2
D. 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:6H2(g)+2CO2(g)![]() C2H5OH(g)+3H2O(g)的数据如图所示。
C2H5OH(g)+3H2O(g)的数据如图所示。
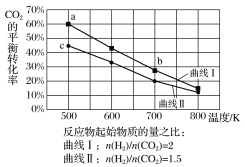
下列说法正确的是( )
A.该反应为吸热反应
B.达平衡时,v正(H2)=v逆(CO2)
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接乙醇燃料电池(DEFC) 具有无毒、来源丰富等优点,其装置如下图所示。装置工作时,下列说法错误的是
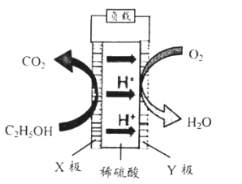
A.化学能转化为电能B.稀硫酸为该电池的电解质溶液
C.电子由Y极流出经负载流向X极D.电池反应为C2H5OH+ 3O2→2CO2+ 3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com