
| 氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | |
| 开始沉淀时的pH | 2.3 | 10.4 | 4.0 | 开始溶解:7.8 |
| 完全沉淀时的pH | 3.7 | 12.4 | 5.2 | 完全溶解:10.8 |
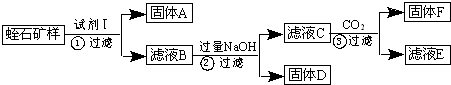

 ,
, ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

 链状结构的同分异构体最多有
链状结构的同分异构体最多有查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


| A、制得粗产品的反应原理为:NH4Cl+NaClO4=NaCl+NH4ClO4↓ |
| B、上述流程中操作Ⅰ为冷却结晶,操作Ⅱ为重结晶 |
| C、洗涤粗产品时,宜用冷水洗涤 |
| D、上述流程中蒸发浓缩时,蒸发至剩余少量溶液时,应停止加热,利用余热将其蒸干,防止晶体飞溅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、化学反应:以石墨作电极电解氯化钠溶液,离子方程式:2Cl-+2H2O
| ||||
| B、化学反应:以银作电极电解硝酸银溶液,离子方程式4Ag++2H2O=4Ag+O2↑+4H+ | ||||
| C、化学反应:铅蓄电池正极反应,离子方程式:PbO2+4H++2e-═Pb2++2H2O | ||||
| D、化学反应:氢氧燃料电池(KOH做电解液)负极反应,离子方程式:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
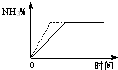
 在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )
在1L恒容密闭容器中充入1mol Z发生反应:2Z(g)═2X(g)+Y(g),反应过程持续升高温度,测得混合体系中Z的体积分数与温度的关系如图所示.下列推断正确的是( )| A、升高温度,平衡常数减小 |
| B、Z在a、c两点的反应速率相等 |
| C、b点时,Z的转化率最小 |
| D、平衡时充入惰性气体时,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量 |
| B、价电子排布为4s24p3的元素位于第四周期第ⅢA族 |
| C、2p和3p轨道形状均为哑铃状,能量也相等 |
| D、在现代化学中,常利用原子光谱上的特征谱线来鉴定元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3是碱 |
| B、Na2CO3是盐 |
| C、Na2CO3是正盐 |
| D、Na2CO3是钠盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com