
【题目】氰化物是剧毒物质,传统生产工艺的电镀废水中含一定浓度的CN-,无害化排放时必须对这种废水进行处理。 可采用碱性条件下的Cl2氧化法处理这种废水,涉及两个反应:反应i,CN- +OH-+Cl2![]() OCN- +Cl-+H2O(未配平);
OCN- +Cl-+H2O(未配平);
反应ii,OCN- + OH-+ Cl2![]() X + Y + Cl-+ H2O(未配平)。
X + Y + Cl-+ H2O(未配平)。
其中反应i中N元素的化合价没有变化,常温下,X、Y是两种无毒的气体。下列判断正确的是( )
A.反应i中氧化剂与还原剂的化学计量数之比为1: 1
B.X、Y是CO2、N2,且均为反应ii的氧化产物
C.该废水处理工艺过程中须采取措施,防止Cl2逸出到空气中
D.处理c(CN-) =0.000 1 mol·L-1的废水106 L,消耗标况下的Cl2 4.48×103L
【答案】AC
【解析】
A. 反应i中氧化剂是Cl2,还原剂是CN-,Cl2中的氯元素的化合价降低2,CN-中的碳元素的合价升高2(由+2升高到+4),因此i中氧化剂与还原剂的化学计量数之比为1: 1,故A正确;
B. 由题中信息可知,X、Y是两种无毒的气体,由反应所涉及的元素可知,X、Y是CO2、N2,N2为反应ii的氧化产物,CO2不是反应ii的氧化产物,故B错误;
C. 氯气有毒,因此该废水处理工艺过程中须采取措施防止Cl2逸出到空气中,故C正确;
D. 处理c(CN-) =0.000 1 mol·L-1的废水106 L,物质的量为0.000 1 mol·L1×106 L=100mol,则失去电子100mol×(2+3)=500mol,因此消耗氯气250mol,标况下的Cl2 体积为250mol×22.4 L·mol1=5.6×103L,故D错误。
综上所述,答案为AC。


科目:高中化学 来源: 题型:
【题目】如图是一些常见含氯产品,根据情况回答下列问题。

(1)下列有关氯单质和氯水的说法正确的是________(填序号)。
①液氯是纯净物,氯水是混合物
②氯气可使湿润的红色布条褪色,所以氯气具有漂白性
③过量的铁在少量的氯气中燃烧生成FeCl2
④新制氯水可使蓝色石蕊试纸先变红后褪色
⑤新制氯水放置数天后酸性将减弱
(2)用化学方程式表示漂白粉的漂白原理________________________ ;
(3)向FeSO4溶液中滴加氯水,溶液变为黄色,写出反应的离子方程式_____
(4)据报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分为稀盐酸)与“84”消毒液(有效成分NaClO),而发生氯气中毒事件,请从氧化还原的角度分析原因________________________(用离子方程式表示)。
(5)一定量铁粉与氯气充分反应后,加适量水,完全溶解后无固体剩余,此时所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等,则已反应的Fe3+和未反应的Fe3+的质量之比是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
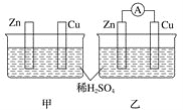
(1)以下叙述中,正确的是_______________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中![]() 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为___________;乙为______。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:____,总反应:___。当电路中转移0.25 mol电子时,消耗负极材料的质量为_____g(Zn的相对原子质量65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3工艺流程如图所示:
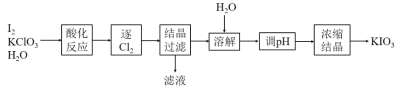
已知:酸化反应产物有KH(IO3)2、Cl2和KCl
(1)“酸化反应”所需I2从海带中提取。经历灼烧海带,浸泡海带灰等步骤,向获得的I-溶液加入MnO2,在酸性条件下生成I2,其离子反应方程式为___。
(2)酸化产物KH(IO3)2所含化学键有___,“调pH”中发生反应的化学方程式为___。
(3)已知KIO3在水中随温度升高而增大,则浓缩结晶的具体步骤是___。
(4)KIO3也可采用“电解法”制备,装置如图所示。
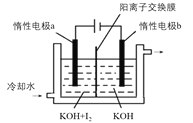
①KOH与I2制备KIO3的离子反应方程式为___。
②电解时阳极的电极反应式:___;阴极的电极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末由NaCl、NaBr、(NH4)2CO3、Na2SO3、Na2SO4中的一种或几种组成,取该固体粉末wg进行如下实验(所加试剂均足量): ( )
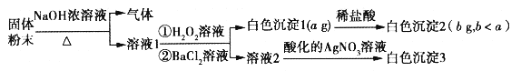
根据实验结果,下列有关说法正确的是( )
A.原固体粉末中含有NaCl
B.若溶液1中只加BaCl2溶液,则生成的白色沉淀1的质量小于或等于a g
C.原固体粉末中必含有(NH4 )2CO3、Na2SO3
D.测定出白色沉淀3的质量可以确定原固体粉末的组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g) ![]() 2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO和NOx,减轻其对大气的污染成为科研工作的热点问题。回答下列问题:
(1)已知下列热化学方程式:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
CH3OH(g) ΔH1,CO2(g)+3H2(g)=CH3OH(g) +H2O(g) ΔH2=-49.0kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ·mol-1。
则ΔH1=_________kJ·mol-1。
(2)用活化后的V2O5作催化剂,氨气可将NO还原成N2。
①V2O5能改变反应速率是通过改变________实现的。
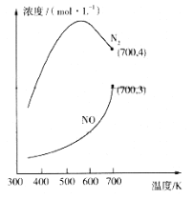
②在1L的刚性密闭容器中分别充入6 mol NO、6 mol NH3和适量O2,控制不同温度,均反应tmin,测得容器中部分含氮气体浓度随温度的变化如图所示。NO浓度始终增大的原因可能是______。700K时,0~tmin内,体系中氨气的平均反应速率为______(用含t的式子表示)。
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应的热化学方程式为:2NO2(g)+4CO(g)![]() 4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
4CO2(g) +N2(g) ΔH<0。某温度下,向10L恒容密闭容器中充入0.1 mol NO2和0.2 mol CO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.96 | 70.7 | 69.7 | 68.75 | 68.75 |
在此温度下,反应的平衡常数Kp =________kPa-1(Kp为以分压表示的平衡常数);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡________(填“右移” “左移”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化学学习小组为探究NO2和SO2的反应,进行如下实验(如图所示)。
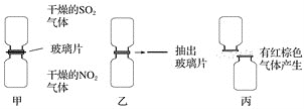
①图甲两集气瓶中________(填“上”或“下”)瓶颜色深。
②图乙中反应的现象是___________________________________________________。
③图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有____________,说明NO2在该反应中显____________性。
④由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:________________________。
(2)某课外活动小组探究镁与NO2的反应。已知镁与CO2反应如下:2Mg+CO2![]() 2MgO+C
2MgO+C
①该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式:______________________________________________________。
②设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)
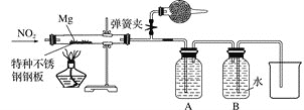
资料信息:2NO2+2NaOH===NaNO3+NaNO2+H2O
Ⅰ.装置A中的试剂是____________。
Ⅱ.干燥管和装置B的作用分别是________________________________________________、____________________。
Ⅲ.实验开始时正确的操作步骤是__________。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是( )
A.工业合成氨反应中加压有利于提高氨气的产率
B.将NO2球浸泡在冷水和热水中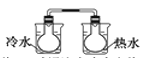
C.红棕色的NO2 ,加压后颜色先变深后变浅
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com