
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1mol二甲醚中含有的C—O键的数目为2NA
B.标准状况下,44.8LHF中含有分子的数目为2NA
C.200g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA
D.在反应Cu2S+O2 2Cu+SO2中,每生成1molCu,转移电子的数目为2NA
2Cu+SO2中,每生成1molCu,转移电子的数目为2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届江西南昌二中、临川一中等高三4月联考二理综化学试卷(解析版) 题型:填空题
发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)  CO(g)+H2(g)可有效提高能源利用率, 若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H ________(填“增大”、“减小”或“不变”)。
CO(g)+H2(g)可有效提高能源利用率, 若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H ________(填“增大”、“减小”或“不变”)。
(2)CO2制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g); ΔH=-49.0 kJ·mol-1,
CH3OH(g)+H2O(g); ΔH=-49.0 kJ·mol-1,
在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g) 和CH3OH(g)
浓度随时间变化如图1所示

①0~9min时间内,该反应的平均反应速率ν(H2) = _________________________。
②在相同条件下,密闭容器的体积压缩至0.5 L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a. 0 < Q < 29.5 b. 29.5 < Q < 36.75 c. 36.75 < Q < 49 d. 49 < Q < 98
③在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2所示,L和X 分别表示温度或压强。
i. X表示的物理量是 ________________ 。
ii. 判断L1与L2的大小关系,并简述理由:________。
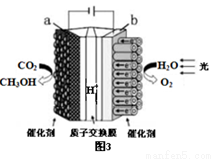
(3)利用铜基催化剂光照条件下由CO2和H2O制备CH3OH的装置示意图如图3所示,该装置工作时阴极的电极反应式是_____________________。
(4)利用CO2和NH3为原料也合成尿素,在合成塔中的主要反应可表示如下:
反应①:2NH3(g)+CO2(g) 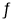 NH2CO2NH4(s) △H1= __________________。
NH2CO2NH4(s) △H1= __________________。
反应②:NH2CO2NH4(s) 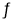 CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
总反应:2NH3(g)+CO2(g) 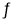 CO(NH2)2(s)+H2O(g) △H=-86.98kJ·mol-1;
CO(NH2)2(s)+H2O(g) △H=-86.98kJ·mol-1;
则反应①的△H1=_______________。
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:填空题
共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是___________
A.金刚石B.氯化钠C.氢氧化钠D.碘
查看答案和解析>>
科目:高中化学 来源:2016届海南海南中学高三考前模拟十一化学试卷(解析版) 题型:选择题
下列有关物质性质或应用的说法正确的是( )
A.钠的金属性比钾强,工业上用钠制取钾(Na+KCl K↑+NaCl)
K↑+NaCl)
B.利用Al2O3制作的坩埚,可用于熔融烧碱
C.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃
D.制水泥和玻璃都用石灰石作原料
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三第五次适应性考试理综化学试卷(解析版) 题型:实验题
某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验。已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于盛放浓硫酸的仪器名称为 。
(2)实验前鼓入N2的目的是 。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是 。
②按观点2,装置B中反应的离子方程式是 ,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号) 。
A.1 mol/L稀硝酸
B.1.5 mol/L Fe(NO3)2溶液
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一下第一次月考化学试卷(解析版) 题型:实验题
NH3及其盐都是重要的化工原料。
(1)合成氨工业对化学的国防工业具有重要意义,写出氨的两种重要用途 。
(2)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 。
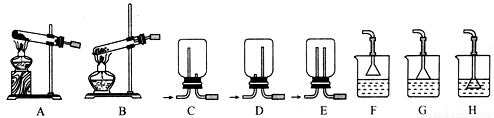
实验室制备氨气,下列方法中适宜选用的是 。
①固态氯化铵加热分解 ②固体氢氧化钠中滴加浓氨水
③氯化铵溶液与氢氧化钠溶液共热 ④加热农氨水
(3)按下图装置进行NH3性质实验。(已知AB两瓶容积相同)
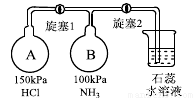
①先打开旋塞1,B瓶中的现象是 ,原因是 ,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是 。
(4)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。白烟的成分是 (填化学式)。
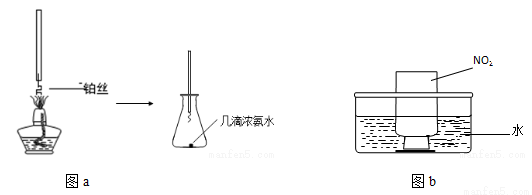
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古包头九中高一下第一次月考化学试卷(解析版) 题型:选择题
下列三组混合气体体积比为①NO2:O2=2:1②NO:O2=2:1③NH3:O2=2:1,将分别盛满上述各种气体的容积相等的三支试管倒置于盛有水的水槽中,最后试管内液面由低到高顺序正确的是
A.③②① B.①②③ C.③①② D.②③①
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
16O和18O是氧元素的两种核素,用NA表示阿伏加德罗常数的数值,下列说法不正确的是( )A.在18g 16O2中含有NA个氧原子
B.16O与18O核外电子排布方式相同
C.在标准状况下,1.12L 16O2和1.12L 18O2均含有0.1NA个氧原子
D.18O 2和16O2化学性质几乎相同
2和16O2化学性质几乎相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一下期中化学试卷(解析版) 题型:选择题
能够说明氯的非金属性比硫强的事实有
①HCl酸性强于H2S的酸性
②将氯气通入H2S溶液中可置换出硫
③氯气与铁反应生成FeCl3,硫与铁反应生成FeS
④硫和氯变成简单阴离子时硫原子得到的电子更多
⑤氯气和氢气的混合气,经强光照射可剧烈反应,而硫与氢气反应需较高温度
A.②③⑤ B.①③⑤ C.①②③ D.①②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com