
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ | ||||||
(1)金属性最强的元素是___________(填元素名称);⑥的离子结构示意图是________________ ;
(2)④、⑤、⑥的原子半径由大到小的顺序为_________________。 (填元素符号);
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是________________。
(4)少量元素⑤的单质通常保存在_______________中;
(5)用电子式表示④和⑤形成化合物的过程: ___________________
(6)常温下,将元素⑧的单质通入元素⑤的最高价氧化物对应的水化物中,其反应的离子方程式为___________________。
(7)在⑧与⑩的单质中,化学性质较活泼的是____________________,(填元素符号)
请设计一个实验方案,证明⑧和⑩的非金属性强弱___________________。
【答案】 钾 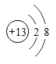 Na>Al>O HClO4> HNO3> H2CO3 煤油
Na>Al>O HClO4> HNO3> H2CO3 煤油 ![]() Cl2+2OH-=Cl-+ClO-+H2O Cl2 将氯水加入溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强
Cl2+2OH-=Cl-+ClO-+H2O Cl2 将氯水加入溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强
【解析】本题考查元素周期表和元素周期律的应用,(1)同主族从上到下金属性增强,同周期从左向右金属性减弱,即金属性最强的是K,即钾;⑥为Al,其离子为Al3+,离子结构示意图为: ;(2)半径大小比较:一看电子层数,电子层数越多,半径越大,二看原子序数,电子层数相同,半径随着原子序数的增加而减小,即Na>Al>O;(3)⑧的最高价氧化物对应水化物是HClO4,HClO4酸性最强,②C的最高价氧化物对应水化物是H2CO3,属于弱酸,③的最高价氧化物对应水化物是HNO3,属于强酸,因此酸性强弱:HClO4.HNO3>H2CO3;(4)⑤为金属钠,少量的金属钠保存在煤油中;(5)④和⑤形成的化合物是Na2O和Na2O2,
;(2)半径大小比较:一看电子层数,电子层数越多,半径越大,二看原子序数,电子层数相同,半径随着原子序数的增加而减小,即Na>Al>O;(3)⑧的最高价氧化物对应水化物是HClO4,HClO4酸性最强,②C的最高价氧化物对应水化物是H2CO3,属于弱酸,③的最高价氧化物对应水化物是HNO3,属于强酸,因此酸性强弱:HClO4.HNO3>H2CO3;(4)⑤为金属钠,少量的金属钠保存在煤油中;(5)④和⑤形成的化合物是Na2O和Na2O2,![]() ;(6)⑧是氯元素,其单质为氯气,⑤的最高价氧化物对应水化物是NaOH,离子反应是Cl2+2OH-=Cl-+ClO-+H2O;(7)⑧是Cl,⑩是Br,同主族从上到下非金属性减弱,因此氯气的氧化性强于溴单质,利用置换反应,氧化剂的氧化性强于氧化产物的氧化性,将氯水加入溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强。
;(6)⑧是氯元素,其单质为氯气,⑤的最高价氧化物对应水化物是NaOH,离子反应是Cl2+2OH-=Cl-+ClO-+H2O;(7)⑧是Cl,⑩是Br,同主族从上到下非金属性减弱,因此氯气的氧化性强于溴单质,利用置换反应,氧化剂的氧化性强于氧化产物的氧化性,将氯水加入溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强。


科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2单质的性质,设计如图所示装置进行实验.装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸.

(1)实验室以二氧化锰和浓盐酸制备氯气的化学方程式是: ;
(2)加入药品前,检查Ⅰ中气体发生装置气密性的操作是: ;
(3)装置Ⅱ的作用是 ;
(4)实验过程中,装置Ⅳ中的实验现象为 ;发生反应的化学方程式为 ;
(5)实验结束后,该组同学在装置Ⅲ中观察b的红色退去,但是并未观察到“a无明显变化”这一预期现象,为了达到这一目的,你认为应在 之间还需添加洗气瓶(选填装置序号),该装置的作用是 ;
(6)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中所用仪器合理的是
A. 用100mL容量瓶配制70mL0.1mol/L盐酸 B. 用托盘天平称取25.20g氯化钠
C. 用20mL的量筒量取13.86mL NaOH溶液 D. 用蒸发皿加热胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F属于短周期主族元素.A的原子半径是短周期中最大,B元素的原子最外层电子数为m、次外层电子数为n,C元素的原子L层电子数为m+n, M层电子数为m﹣n,D元素与C元素同主族,E元素原子与B元素原子的核外电子数之比为2:1,F的一种原子中,质量数与质子数之差为零.
(1)写出元素的名称C________E________F________.
(2)C在周期表中的位置是________
(3)A2B2的电子式为______.
(4)A、B形成的简单离子的半径由大到小的顺序为________.(用对应的化学符号填空,下同)
(5)A、E形成的是________(填共价或离子)化合物
(6)B、E两种元素形成的气态氢化物中稳定性更强的是______;
(7)由元素C形成的单质Y与由A、B、F三种元素形成的化合物X的水溶液反应的离子方程式为___________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液液 | Na2CO3 | 稀盐酸 |
③ | CO2 | Na2O2 | H2O |
④ | FeCl3溶液 | Cu | 稀硫酸 |
A. ①③ B. ①④ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)通常用作火箭的高能燃料,N2O4 作氧化剂。请回答下列问题:
⑴已知:N2(g)+2O2(g)=2NO2(g) △H=+a kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-b kJ/mol
2NO2(g)![]() N2O4(g) △H=-c kJ/mol
N2O4(g) △H=-c kJ/mol
写出气态肼在气态 N2O4 中燃烧生成氮气和气态水的热化学方程式 。
⑵工业上常用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为 。
⑶N2、H2 合成氨气为放热反应。800K 时向下列起始体积相同的密闭容器中充入 2mol N2、3mol H2, 甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡。

达到平衡时,平衡常数 K 甲 K 乙(填“﹥”“﹤”或“=”)。
② 达到平衡时 N2 的浓度 c(N2)乙 c(N2)丙(填“﹥”“﹤”或“=”)。
③ 对甲、乙、丙三容器的描述,下列说法正确的是
A. 乙容器气体密度不再变化时,说明此反应已达到平衡状态
B. 在甲中充入稀有气体 He,化学反应速率加快
C. 将甲中的活塞往下压至原体积的一半,平衡向右移动
D.丙容器温度不再变化时说明已达平衡状态
⑷ 氨气通入如图电解装置可以辅助生产 NH4NO3,该电解池阴极反应式为 。

⑸ 在 20mL 0.2mol/L 的 NH4NO3 溶液中加入 10mL 0.2mol/L NaOH 溶液后显碱性,溶液中所有离子浓度大小关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容下发生反应:A(s)+B(g) = C(g)+D(g) △H<0。则下列判断正确的是( )
A.向该容器中加入少量A,反应速率增大
B.向该容器中充入氩气,反应速率增大
C.将粉末状A代替块状A能加快反应
D.该反应为放热反应,无需加热即可发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com