
| A. | 转移溶液时使用的烧杯未洗涤 | B. | 定容时俯视读取刻度线 | ||
| C. | 原容量瓶洗净后未干燥 | D. | 转移时有少量溶液流出瓶外 |
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 38 | B. | 50 | C. | 88 | D. | 126 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

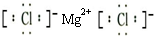 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
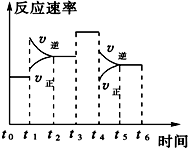 (1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.
(1)25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-92.4kJ/mol 反应过程如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4与稀HNO3反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | 用稀H2SO4除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | 少量Ca(OH)2溶液与NaHCO3混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| J | |||
| R |
 ; 元素T最高价氧化物对应水化物化学式是Cl2O7.
; 元素T最高价氧化物对应水化物化学式是Cl2O7. ,含有共价键是极性键(填极性键或非极性键).
,含有共价键是极性键(填极性键或非极性键).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com