
��10�֣�A��B��C��D��E���������к���ͬһ��Ԫ�أ����ת����ϵ����ͼ��ʾ��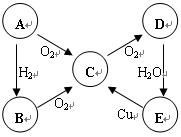
��1�����A�ǵ���ɫ���壬
��д��B��E�Ļ�ѧʽ��B��������E���� ����
��C��D�Ļ�ѧ����ʽΪ_____________________��
�۽�����������Cͨ����BaCl2��Һ�У�����˵����ȷ����___________������ĸ��ţ���
a����Һû�����Ա仯
b����Һ�г��ְ�ɫ����
c��������ͨ��Cl2��NH3����Һ�����ְ�ɫ����
��2�����A����ɫ���壺
D��E�Ļ�ѧ����ʽΪ���������������� ��
E��C�����ӷ���ʽΪ���������������� ��
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����¶� Ũ�� |
a���� 400�� |
b���� 425�� |
c���� 450�� |
d���� 475�� |
e���� 500�� |
| c��O2�� | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
| c��SO3�� | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |

| c2(SO3) |
| c2(SO2)��c(O2) |
| c2(SO3) |
| c2(SO2)��c(O2) |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



| ��O3 | ��Zn��H2O |




�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ�������
Ԫ�����ڱ������ڵ�һ���������ʾ�������й�A��B��C��D��E����Ԫ�ص������У���ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com