
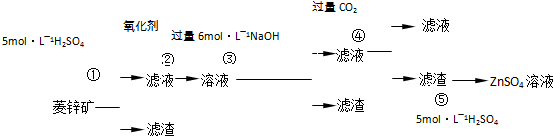
п������һ�ְ�ɫ���ϡ���ҵ������ZnSO4��BaS��Һ��϶��ɣ�BaS+ZnSO4 = ZnS��+BaSO4���������ǹ�ҵ�������̡���ش��й����⣺
��.ZnSO4��Һ���Ʊ����ᴿ
�й����ϣ���֪Zn(OH)2��Al(OH)3���ƣ������ڹ�����NaOH��Һ����Na2ZnO2��
��п�����Ҫ�ɷ���ZnCO3��������SiO2��FeCO3��Cu2(OH)2CO3�ȡ�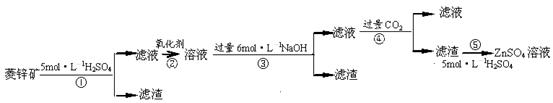 ��1������ʹ�õ���������������е� ������ţ��������� ��
��1������ʹ�õ���������������е� ������ţ��������� ��
| A��Cl2 | B��H2O2 | C��KMnO4 | D��ŨHNO3 |
 �й����ݣ� Ba��s����S��s����2O2��g����BaSO4��s������H = ��1473.2 kJ?mol-1
�й����ݣ� Ba��s����S��s����2O2��g����BaSO4��s������H = ��1473.2 kJ?mol-1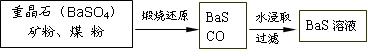

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ���ջ�ԭ |
| ˮ��ȡ |
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
п������һ�ְ�ɫ���ϣ�����Ҫ�ɷ���������ˮ��п�κͱ��Σ�������
A��ZnCO3��BaCl2
B��ZnCl2��BaCO3
C��ZnS��BaSO4
D��ZnCO3��Ba��NO3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ�����и�������ѧ��ĩͳһ�������ۻ�ѧ�Ծ��������棩 ���ͣ������
п������һ�ְ�ɫ���ϡ���ҵ������ZnSO4��BaS��Һ��϶��ɣ�BaS+ZnSO4= ZnS��+BaSO4������������¹�ҵ�������̻ش��й����⡣
I��ZnSO4��Һ���Ʊ����ᴿ��
�й����ϣ�a����п�����Ҫ�ɷ���ZnCO3��������SiO2��FeCO3��Cu2(OH)2CO3�ȣ�b��Zn(OH)2��Al(OH)3���ƣ������ڹ�����NaOH��Һ����Na2ZnO2��
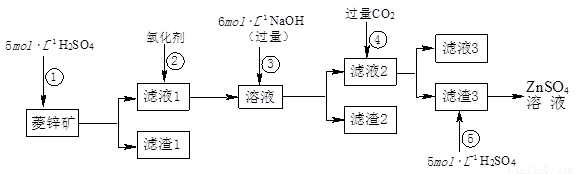
��1������1�Ļ�ѧʽΪ ������ʹ�õ���������������е� ������ţ���
A��Cl2 B��H2O2 C��KMnO4 D��ŨHNO3
��2������2����Ҫ�ɷֵĻ�ѧʽΪ ��Ϊ�˴ﵽ�ۺ����á����ܼ��ŵ�Ŀ�ģ��������̲�����е�CO2���������ڲ��� ��ѡ��١��ڡ��ۡ��ݣ���
��3������ܷ��������ӷ�Ӧ����ʽΪ ��
II��BaS��Һ���Ʊ�
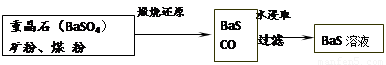
�й����ݣ�Ba��s����S��s����2O2��g����BaSO4��s�� ��H1 = ��1473.2 kJ•mol��1
C��s���� 1/2O2��g����CO��g�� ��H2 = ��110.5 kJ•mol��1
Ba��s���� S��s����BaS��s�� ��H3 = ��460 kJ•mol��1
��4�������ջ�ԭ�IJ����ΪBaS��CO�����䷴Ӧ���Ȼ�ѧ����ʽΪ��
��
��.��ȡп����
��5��������в����ʹ����������������ĺ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com