
 C和Si元素在化学中占有极其重要的地位.
C和Si元素在化学中占有极其重要的地位.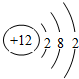 ;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.
;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.分析 (1)Si是28号元素,原子核外有3个电子层、最外层电子数是4,据此写出Si原子的核外电子排布式;
(2)SiC属于原子晶体,微粒间存在共价键,硅的原子半径大于碳,所以硅碳键的键能小于碳碳键;
(3)根据电子数相等计算M原子电子数,根据原子中电子数=原子序数确定元素,根据氯化钠中离子配位数确定M2+的配位数,利用均摊法计算晶胞中离子数目,离子晶体的熔点与晶格能成正比,晶格能与离子半径成反比;
(4)富勒烯中每个碳原子形成3个σ键,据此确定C原子杂化方式,每个C原子平均占有1.5个σ键,据此计算1mol C60分子中含有σ键的物质的量.
解答 解:(1)Si元素为14号元素,原子核外有14个电子,所以核外电子排布式为:1s22s22p63s23p2,
故答案为:1s22s22p63s23p2;
(2)SiC属于原子晶体,微粒间存在共价键,硅的原子半径大于碳,所以硅碳键的键能小于碳碳键,所以SiC的熔点<金刚石,
故答案为:共价键;<;
(3)氧化物MO的电子总数与SiC的相等,则M原子中电子数为12,原子中电子数=原子序数=12,所以M为Mg元素,镁的原子结构示意图为 ,氯化钠中阴阳离子配位数为6,所以MgO中Mg2+的配位数为6,根据均摊法可知,氯化钠晶胞中含有氯离子数目为4,钠离子数目为4,所以氧化镁中氧离子、镁离子数分别为4、4,MgO和CaO都是离子晶体,镁离子半径小于钙离子,且二者所带电荷相等,所以MgO的晶格能大于CaO,所以MgO的熔点高于CaO,
,氯化钠中阴阳离子配位数为6,所以MgO中Mg2+的配位数为6,根据均摊法可知,氯化钠晶胞中含有氯离子数目为4,钠离子数目为4,所以氧化镁中氧离子、镁离子数分别为4、4,MgO和CaO都是离子晶体,镁离子半径小于钙离子,且二者所带电荷相等,所以MgO的晶格能大于CaO,所以MgO的熔点高于CaO,
故答案为: ;6;4;4;Mg 2+半径比Ca 2+小,MgO的晶格能大;
;6;4;4;Mg 2+半径比Ca 2+小,MgO的晶格能大;
(4)富勒烯中每个碳原子形成3个σ键,每个C原子平均占有1.5个σ键,则1mol C60分子中含有σ键的物质的量为90mol,故答案为:90.
点评 本题考查较综合,涉及原子杂化方式的判断、晶格能等知识点,根据存在的σ键个数确定原子杂化方式,根据离子晶体熔点与晶格能、离子半径的关系来分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y均只有1种氧化物 | |
| B. | 原子半径:X<Y<Z | |
| C. | 简单气态氢化物的热稳定性:X>W | |
| D. | Y、Z、W的最高价氧化物的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深 | |
| B. | 红棕色的NO2,加压后颜色先变深后变浅 | |
| C. | 实验室用排饱和食盐水法收集氯气 | |
| D. | 工业上利用O2与SO2反应制取SO3时通入过量O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com