
| A. | c(A)=1.0mol/L c(B)=0.2mol/L | B. | c(B)=0.5mol/L c(C)=1.2mol/L | ||
| C. | c(A)=0.4mol/L c(C)=1.8mol/L | D. | c(A)=0.9mol/L c(B)=0.5mol/L |
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
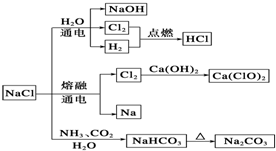
| A. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 待提纯的物质 | 除杂的试剂 | 操作方法 |
| A | NO2(NO) | O2 | 收集气体 |
| B | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| C | FeCl2溶液(FeCl3) | 足量铁粉 | 过滤 |
| D | KCl溶液(MgCl2) | NaOH溶液 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1 L pH=1的H2SO4溶液中,SO${\;}_{4}^{2-}$数目为0.1NA | |
| B. | 将7.8 g Na2O2放入足量的CO2和水蒸气组成的气体中充分反应,转移电子总数为0.1NA | |
| C. | 9 g重氧水(H${\;}_{2}^{18}$O)含电子总数为10NA | |
| D. | 常温常压下,2.24 L正戊烷、异戊烷及新戊烷的混合物,含C-H数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解熔融的氯化钠来制备金属钠 | |
| B. | 工业上用电解熔融的氯化铝来制备金属铝 | |
| C. | 工业上用电解熔融的氯化镁来制备金属镁 | |
| D. | 工业上可用一氧化碳还原赤铁矿来制得铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com