
| 选项 | 操作 | 现象 | 结论 |
| A | 灼烧白色粉末,直接观察火焰颜色 | 火焰呈黄色 | 原粉末中有Na+无K+ |
| B | 将一块Al箔在酒精灯火焰上灼烧 | Al箔熔融而不滴落 | Al2O3具有较高的熔点 |
| C | 将一小块Na放入硫酸铜溶液中 | 有铜单质析出 | Na能置换出硫酸铜中的铜 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,不能证明无K+,因为黄光可遮住紫光,K+焰色反应需透过蓝色的钴玻璃滤去黄光后观察;
B.氧化铝的熔点高,包裹在Al的外面;
C.金属钠和盐溶液之间的反应先是和其中的水反应;
D.高温下,铁和水蒸气反应生成黑色的四氧化三铁.
解答 解:A.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,并不能证明无K+,Na+焰色反应为黄色,可遮住紫光,K+焰色反应需透过蓝色的钴玻璃滤去黄光后观察,故A错误;
B.因三氧化二铝的熔点高于铝的熔点,而三氧化二铝在铝的表面,所以加热铝箔的时候铝熔化了但是不会滴落,故B正确;
C.将一小块Na放入硫酸铜溶液中,先是和其中的水反应,不会置换出金属铜,故C错误;
D.高温下,铁和水蒸气反应生成黑色的四氧化三铁,所以得不到红色粉末,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,知道铁和水蒸气高温下产物成分,题目难度不大.


科目:高中化学 来源: 题型:解答题


 .
. (只写一种)
(只写一种)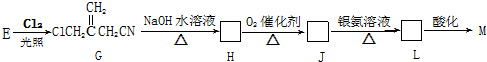


 (实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)
(实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变是指在恒压、恒温下,体系不做体积功,只做其它功的变化过程的热效应 | |
| B. | 书写热化学方程式时若不标明温度和压强,则表示是在0℃、101kpa条件下的反应热 | |
| C. | 化学反应中的能量变化,是由化学反应中化学键断裂时吸收的能量与生成物中化学键形成时放出的能量不同所导致的 | |
| D. | 吸热反应的△H<0,放热反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 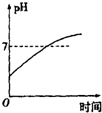 | B. | 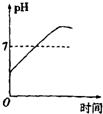 | C. | 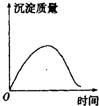 | D. | 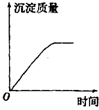 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
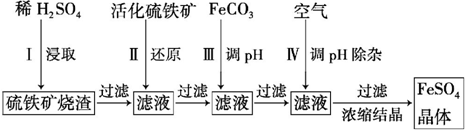
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
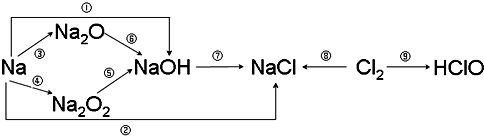
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
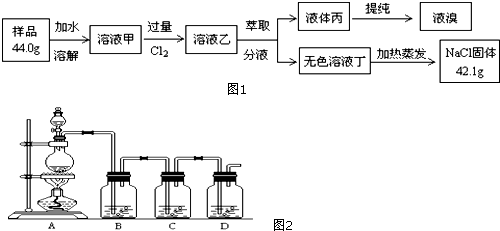
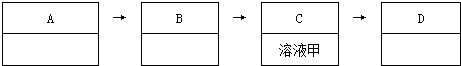
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
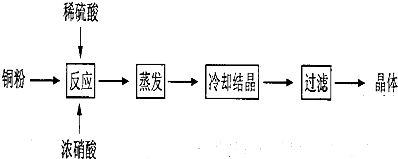
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
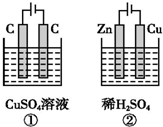 如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个实验装置中,溶液的体积均为 200mL,开始时电解质溶液的浓度均为 0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 产生气体的总体积:①>② | |
| B. | 电极上析出物质的总质量:②>① | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | ①中阳极的电极反应式:4OH--4e-═2H2O+O2↑;②中阴极的电极反应式:2H++2e-═H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com