
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述不正确的是( )

A. 分子中含有4种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1 mol 分枝酸最多可与2 mol NaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】—氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。

(1)某小组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。
①装置B的主要作用是_____。
②以无水ZnCl2为催化剂,圆底烧瓶中发生反应的化学方程式为____。如果实验时圆底烧瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mLc1mol/LNaOH溶液充分吸收,以甲基橙作指示剂,用c2mol/L盐酸标准液对吸收液进行滴定,最终消耗V2mL盐酸,则所收集CH3Cl的物质的量为_____mol。(已知:2CH3Cl+3O2=2CO2+2H2O+2HCl)
(2)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:
化学键 | C-Cl | C-Br |
键能/(kJ·mol-1) | 330 | 276 |
化合物 | AgCl | AgBr |
Ksp | 1.8×10-10 | 5×10-13 |
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式:_____。
②设计实验证明HBr是强酸:____(简要说明实验操作、现象和结论)
③CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中的键能和Ksp数据解释原因:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图实验装置探究铜丝与过量浓硫酸的反应及SO2的部分化学性质。

(1)试管①中发生反应的化学反应方程式为_____________________。
(2)装置③证明SO2溶液显__________性,同时证明SO2_________(填“能”或“不能”)漂白pH试纸。
(3)实验完毕,取下试管②并加热,可观察的现象是____________,该实验可以达到的目的是_______。
(4)实验初期发现大试管内有白色沉淀生成,该沉淀的化学式为_____________。
(5)终止试管①中反应的方法是_____________。
(6)基于环境保护的考虑,如图是某学生提出的实验改进方法,其中棉花团上应浸取的试剂为_________(任填一种)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温,0.1mol/Lt溶液与0.1mol/L u溶液的pH均为1,下列说法正确的是( )
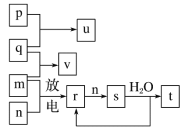
A. 元素的非金属性:Z>Y>X,原子半径:X<Z<Y
B. Y、W的氧化物对应的水化物均为强酸
C. s溶于水的反应中,氧化剂与还原剂的物质的量之比为2∶1
D. v的电子式可表示为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14gC2H4含有的单键数目为3NA
B.99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
D.100 g CaS与CaSO4的混合物中含有32 g硫,则含有的氧原子数为1.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
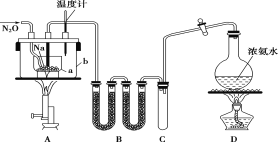
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为______。
(2)步骤①中先加热通氨气的目的是_______________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__________;步骤③中最适宜的加热方式为 ______(填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为 _______。
(4)图中仪器a用的是铁质而不用玻璃,其主要原因是_____。
(5)步骤④中用乙醚洗涤的主要目的是_______。
(6)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水。下列说法错误的是( )
A.步骤①后可依次用KSCN溶液和酸性KMnO4溶液来检测溶液中铁元素的价态
B.步骤②发生后,溶液的酸性增强
C.步骤③,将溶液蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥可得到绿矾
D.为确保铁黄的产率,尽可能将步骤④中的pH值调大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com