
| A. | 0.1molCH3+所含的电子数为8NA | |
| B. | T℃时,1L pH=6的纯水中含有1×10-6NA个OH- | |
| C. | 23g NO2和23g N2O4的混合气体所含原子数为3NA | |
| D. | 10g 46%的乙醇的水溶液中所含H原子数为0.6NA |
分析 A、CH3+中含8个电子;
B、pH=6的水中,氢离子浓度等于氢氧根浓度,均等于10-6mol/L;
C、NO2和 N2O4的最简式均为NO2;
D、在乙醇溶液中,除了乙醇分子外,水也含H原子.
解答 解:A、CH3+中含8个电子,故0.1molCH3+中含0.8NA个电子,故A错误;
B、pH=6的水中,氢离子浓度等于氢氧根浓度,均等于10-6mol/L,故1L溶液中氢氧根的物质的量为10-6mol,个数为10-6NA,故B正确;
C、NO2和 N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,故含3NA个,故C正确;
D、在乙醇溶液中,除了乙醇分子外,水也含H原子,故溶液中的氢原子的个数多于0.6NA个,故D错误.
故选AD.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
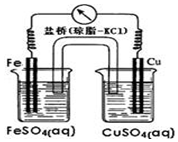
| A. | 铜作正极,发生氧化反应 | |
| B. | 外电路中电流方向为Fe→Cu | |
| C. | Fe电极的电极反应式为Fe-3e-=Fe3+ | |
| D. | 盐桥将两电解质溶液连接起来,传导电流,通过等量的K+和Cl-的定向移动,使两电解质溶液保持电中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
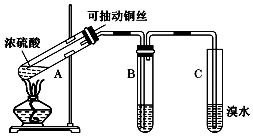 某兴趣小组设计出如图所示装置来改进教材中“铜与浓硫酸反应”实验
某兴趣小组设计出如图所示装置来改进教材中“铜与浓硫酸反应”实验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 铝箔在空气中受热可以融化,由于氧化膜的存在,融化的铝并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS | |
| B. | 已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2 | |
| C. | 已知Na与水反应生成NaOH,推测Fe与水蒸汽反应生成Fe(OH)3 | |
| D. | 已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com