
常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0.5L混合溶液。
(1)溶液中共有________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是____________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=_________mol。
(1)7 (2)CH3COOH和CH3COO- (3)0.006
【解析】(1)醋酸钠溶液盐酸,发生反应CH3COONa+HCl=CH3COOH+NaCl。根据物质的量可知,醋酸钠过量,即溶液中含有0.006mol醋酸钠、0.004mol醋酸和0.004mol氯化钠。醋酸存在电离平衡,醋酸钠存在水解平衡,所以含有的微粒是CH3COOH、H2O、H+、OH-、CH3COO-、Na+、Cl-共计是7种。
(2)根据原子守恒可知,CH3COOH和CH3COO- 的物质的量之和一定等于0.01mol。
(3)根据电荷守恒可知n(CH3COO-)+n(OH-)+n(Cl-)=n(H+)+n(Na+),所以n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.01mol-0.004mol=0.006mol。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
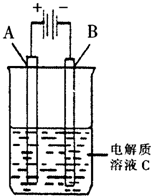 (2011?丹东模拟)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.
(2011?丹东模拟)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料. N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH- N2H+5+OH-;N2H+5+H2O
N2H+5+OH-;N2H+5+H2O N2H+6+OH-
N2H+6+OH-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com