
【题目】科研人员最近发明了一种水电池,这种电池能利用淡水和海水之间的含盐量差进行供电,该电池的化学反应为:5MnO2+2Ag+2NaCl→Na2Mn5O10+2AgCl
(1)简述Na2O熔点比NaCl高的其原因。_______________________
(2)将Al粉和MnO2混合,经高温引发反生反应,写出化学反应方程式。__________________________,若反应中生成5.5kg单质,则转移电子的数目是________个。
(3)元素周期表中,铁(Fe)和锰(Mn)位于同周期。向化合物X的溶液中,滴加NaOH溶液时,发生反应:X+3NaOH→3Y+Fe(OH)3↓。X的化学式可能是________________、________________。
(4)将SO2通入Fe2(SO4)3溶液中,溶液变为浅绿色,且酸性增强,请写出离子方程式。______________________
【答案】O2-电荷比Cl-多,离子半径小,Na2O中离子键比NaCl强,故Na2O中熔点高 2Al+3MnO2 ![]() Al2O3+3Mn 400NA Fe(NO3)3 FeCl3 2Fe3++SO32-+2H2O→2Fe2++SO42-+4H+
Al2O3+3Mn 400NA Fe(NO3)3 FeCl3 2Fe3++SO32-+2H2O→2Fe2++SO42-+4H+
【解析】
(1)Na2O和NaCl都是离子晶体,用晶格能大小解释Na2O熔点比NaCl高的原因: O2-电荷比Cl-多,离子半径小,Na2O中离子键比NaCl强,故Na2O中熔点高;
(2)将Al粉和MnO2混合,经高温引发反生反应,生成锰和三氧化二铝,化学反应方程式 2Al+3MnO2 ![]() Al2O3+3Mn,若反应中生成5.5kg单质,n(Mn)=5.5×103g/55g·mol-1=100mol,则转移电子的数目是400NA个。
Al2O3+3Mn,若反应中生成5.5kg单质,n(Mn)=5.5×103g/55g·mol-1=100mol,则转移电子的数目是400NA个。
(3)元素周期表中,铁(Fe)和锰(Mn)位于同周期。向化合物X的溶液中,滴加NaOH溶液时,发生反应:X+3NaOH→3Y+Fe(OH)3↓。X为铁离子的一元酸盐,X的化学式可能是 Fe(NO3)3、FeCl3 。
(4)铁离子具有氧化性,将SO2通入Fe2(SO4)3溶液中,溶液变为浅绿色,且酸性增强,离子方程式2Fe3++SO32-+2H2O=2Fe2++SO42-+4H+。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列叙述不正确的是( )
]。下列叙述不正确的是( )

A.NaHA溶液中,HA-的水解能力小于HA-的电离能力
B.lg[K2(H2A)]=-4.2
C.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
D.0.1 mol·L1 NaHA溶液中:c(Na+)+c(A2)+c(H2A)+c(HA)=0.2 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )

A. X的氢化物比R的氢化物稳定
B. 原子半径大小顺序是Z>Y>X
C. Y、R形成的化合物YR2能使KMnO4溶液褪色
D. X、Z可形成化合物XZ5 , 分子中各原子均满足最外层8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A、C、D均为无色气体。

(1)写出有关的物质化学式。X: C: E: F:
(2)写出反应①的化学方程式_____________________________________
(3)写出反应②的离子方程式_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙醇的说法正确的是( )
A. 通过加成反应可制取乙酸乙酯B. 可用淀粉水解产物来制取
C. 与乙醚互为同分异构体D. 乙醇不能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸。
(1)写出亚硝酸的电离方程式___;
(2)酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2,则产物中含氮物质的化学式为__;
(3)请你设计一个实验方案鉴别氯化钠和亚硝酸钠(提示AgNO2呈白色,在溶液中以沉淀形式存在)___;
(4)工业废水中NO2-可用铝粉除去,产生无毒无味的气体。若反应过程中转移6mol电子,则生成该气体在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,甲容器中充满35Cl2,乙容器中充满37Cl2,下列叙述不正确的是
A. 若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37
B. 若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37
C. 若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35
D. 若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。气体X和液体Y不可能是( )
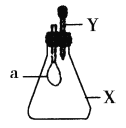
A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com