
下列有关物质的性质和该性质的应用均正确的是
A、晶体硅具有半导体性质,可用于生产光导纤维
B、H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生O2
C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸
D、铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、Na2SO4、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下 ,该同学得出的结论正确的是( )
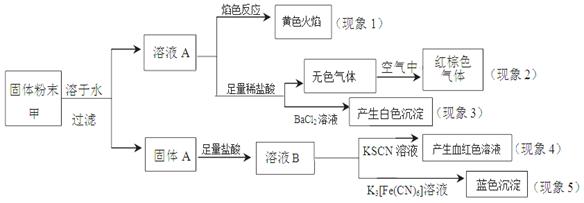
A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素
B.根据现象2可推出该固体粉末中一定含有NaNO2
C.根据现象3可推出该固体粉末中一定含有Na2SO4
D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰干电池在放电时,电池总反应方程式可以表示为Zn+2MnO2+2NH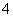 ===Zn2++Mn2O3+2NH3+H2O。在此电池放电时,正极(碳棒)上发生反应的物质是( )
===Zn2++Mn2O3+2NH3+H2O。在此电池放电时,正极(碳棒)上发生反应的物质是( )
A.MnO2和NH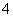 B.Zn2+和NH
B.Zn2+和NH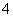
C.Zn D.碳棒
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验1、2中Al所作的电极是否相同?
________________________________________________________________________。
(2)指出铝和石墨的电极并写出实验3中的电极反应式和电池总反应方程式。
铝为( ):
________________________________________________________________________。
石墨为( ):
________________________________________________________________________。
电池总反应:
________________________________________________________________________。
(3)实验4中的铝作正极还是负极?________,为什么?
________________________________________________________________________
________________________________________________________________________。
(4)解释实验5中电流计指针偏向铝的原因:
________________________________________________________________________
________________________________________________________________________。
(5)根据实验结果总结:在原电池中金属铝作正极还是负极受到哪些因素的影响?________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有FeO、Fe2O3的混合物若干克,在足量H2气流中,加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解,需1 mol·L-1的盐酸的体积至少为
A.0.05 L B.0.1 L C.0.2 L D.1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产流程如下:
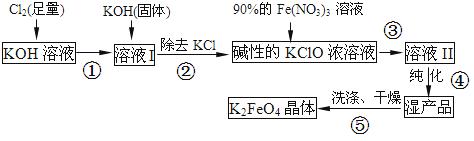
(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 ____mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号).
A.与溶液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使副产物KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述正确的是
A.“加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质
B.“酸可以除锈”,“热的纯碱溶液去油污”都是发生了化学变化
C.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质
D.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝
查看答案和解析>>
科目:高中化学 来源: 题型:
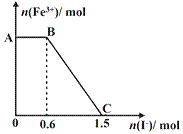
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I- =2Fe2++I2
C.若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则有蓝色沉淀生成
D.开始加入的K2Cr2O7为0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,美国佛罗里达大学最新研制出了一种新型碳素纳米薄膜,密度仅为钢的1/10,强度却是钢的250倍。这种纳米薄膜由许多纳米管组成,纳米管的直径只有人头发的1/50000,其研究成果已用于医学、军事、化工及生活用品等领域。这种新型薄膜的原材料是碳素60,它是一种球状分子,强度是钻石的2倍。下列说法错误的是(D)
A. 纳米薄膜是由许多碳素纳米管组成的,直径很小
B. 新型纳米薄膜的原材料是C60,它是一种球状分子
C. 纳米薄膜用途广泛,可用于航空、军事、太空及日常生活各个领域
D. 纳米材料微粒粒径一般从几纳米到几十纳米(1 nm=10-9m),因此纳米材料属于胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com