

分析 (1)1g乙醇的物质的量=$\frac{1}{46}$mol,1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,1mol乙醇完全燃烧生成二氧化碳和液态水放出的热量是1366.7kJ,据此写出其热化学反应方程式;
(2)燃料电池中,通入燃料的电极是负极,负极上失电子发生氧化反应;
(3)金属铜6.35g,其物质的量为$\frac{6.35g}{64g/mol}$=0.099≈0.1mol,根据电极反应式结合电子守恒来计算;
(4)根据电极反应式结合电子守恒来计算.
解答 解:(1)1g乙醇的物质的量=$\frac{1}{46}$mol,1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,1mol乙醇完全燃烧生成二氧化碳和液态水放出的热量是1366.7kJ,所以其热化学反应方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.7kJ/mol,
故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.7kJ/mol;
(2)该燃料电池中,负极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为C2H5OH+16OH--12e-=2CO32-+11H2O;
故答案为:C2H5OH+16OH--12e-=2CO32-+11H2O;
(3)金属铜6.35g,其物质的量为$\frac{6.35g}{64g/mol}$=0.099≈0.1mol,根据电极反应:Cu2++2e-=Cu,转移电子的物质的量是0.2mol,在燃料电池的正极上发生电极反应:
O2+2H2O+4e-=4OH-,当转移电子的物质的量是0.2mol时,消耗氧气的物质的量是0.05mol,体积是0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(4)乙池中发生的反应分别是:阳极上:2H2O-4e-=O2↑+4H+,阴极上Cu2++2e-=Cu,2H++2e-=H2↑,100mL3.00mol•L-1的CuSO4溶液中铜离子物质的量是:0.3mol,铜离子得电子的是0.6mol,若两电极产生的气体恰好相等时(假设标准状况下),设均为nmol,则2n+0.6=4n,解得n=0.3,即装置在转移电子的物质的量是1.2mol,乙醇燃料电池的负极上发生反应:C2H6O+16OH--12e-=2CO32-+11H2O,当转移电子是1.2mol,消耗乙醇的物质的量是0.1mol,质量是0.1mol×46g/mol=4.6g,
故答案为:4.6.
点评 本题考查了原电池原理和电解池原理的应用,注意根据串联电路中转移的电子的物质的量相等结合电极方程式计算分析,题目难度中等,侧重于考查学生的分析能力和计算能力.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:解答题
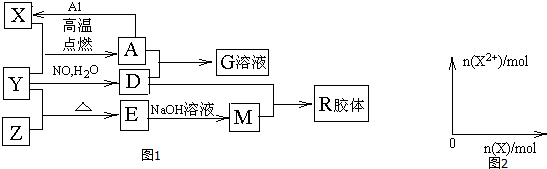
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开化学键的过程会放出能量 | |
| B. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 化合反应均为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| B. | 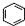 、 、 和 和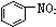 均属于芳香烃 均属于芳香烃 | |
| C. | 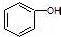 和 和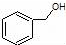 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 结构简式为C2H5-OH的核磁共振氢谱上有2个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极质量不断减少 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)═H2O(g)△H=-242kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和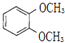 不属于同分异构体的 不属于同分异构体的 | |
| B. | 质量相同的C3H6 和C2H6完全燃烧时消耗氧气的质量较少的是C3H6 | |
| C. | 连接四个不同基团的碳原子为“手性碳原子”,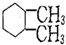 含有两个手性碳原子 含有两个手性碳原子 | |
| D. | 标准状况下22.4 L溴乙烷所含化学键总数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属活动性A>B | |
| B. | 还原性B>A | |
| C. | 在后者装置中金属A发生还原反应,金属B发生氧化反应 | |
| D. | 金属B的表面上明显有气泡产生,金属A表面无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com