
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)提出猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含有________(填化学式,下同)。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含有________。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精
d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的反应的离子方程式为__________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有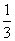 的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________。
的Br-被氧化成Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________。
解析 (2)①若氧化性Fe3+>Br2,则Br2不能氧化Fe2+,故溶液呈黄色是加入的Br2的颜色。②若氧化性Br2>Fe3+,则Br2能将Fe2+氧化成Fe3+,故溶液呈黄色是因为生成的Fe3+显黄色。(4)②氧化性Br2>Fe3+,则还原性Fe2+>Br-,Cl2通入FeBr2溶液中先与Fe2+反应,若Cl2还有剩余再与Br-发生反应。现有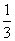 的Br-被氧化成Br2,故Fe2+全部被氧化成Fe3+。n(Cl2)=0.10 mol,得电子0.20 mol,根据得失电子守恒应有:n(Fe2+)+
的Br-被氧化成Br2,故Fe2+全部被氧化成Fe3+。n(Cl2)=0.10 mol,得电子0.20 mol,根据得失电子守恒应有:n(Fe2+)+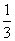 n(Br-)=0.20 mol,又因为
n(Br-)=0.20 mol,又因为
n(Br-)=2n(Fe2+),则n(FeBr2)=0.12 mol,c(FeBr2)=1.2 mol·L-1。
答案 (2)①Br2 ②Fe3+
(3)d 溶液呈血红色 b CCl4层呈无色
(4)①2Fe2++Br2===2Fe3++2Br- ②1.2 mol·L-1


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知2SO2+O2
 2SO3为放热反应,对该反应的下列说法正确的是( )
2SO3为放热反应,对该反应的下列说法正确的是( )
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
将1molN2气体和3molH2气体在2L的恒容容器中,并在一定条件下发生如下反应:
N2(g)+3H2(g)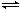 2NH3(g),若经2s后测得NH3的浓度为0.6 mol·L-1,现有下列几种说法:其中正确的是
2NH3(g),若经2s后测得NH3的浓度为0.6 mol·L-1,现有下列几种说法:其中正确的是
①用N2表示的反应速率为0.15 mol·L-1·s-1
②用H2表示的反应速率为0.6 mol·L-1·s-1
③2s时N2与 H2的转化率相等
④2s时H2的浓度为0.6mol·L-1
A.①②④ B.①③④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是 ( )。

A.X为SO2气体,也可为Na2SO3溶液
B.设备Y为蒸馏塔
C.在提取溴的过程中一定有Br-被氧化
D.工业上每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成________________________________________________________________________________________________________________________________。
(2)氯气能使湿润的红色布条褪色。对于使湿润的红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①___________________________ ②____________________________ ③___________________________ ④H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:_________ 实验③:把红色布条放在水里,布条不褪色 | ________________________________________________________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示。则原H2SO4物质的量浓度是 ( )。
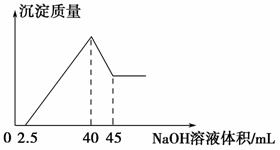
A.1 mol·L-1 B.2 mol·L-1
C.3 mol·L-1 D.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为 ( )。
A.3.2 g B.4.0 g
C.4.2 g D.4.6 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com