
在含有Fe3+、Fe2+、Al3+、NH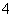 的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是 ( )
的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是 ( )
A.Fe3+、Al3+ B.Al3+
C.Fe2+、NH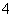 D.Fe3+
D.Fe3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说 法不正确的是( )
法不正确的是( )
A.合金的熔点一般比组分金属低
B. 铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na)
铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出
D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列混合物的除杂方法与发生反应的类型均正确的是
| 混合物 | 加入试剂或方法 | 反应类型 | |
| A | 除去O2中的CO | 通入炽热的CuO中 | 化合反应 |
| B | 除去CO2中的HCl | 通入饱和NaHCO3溶液中 | 中和反应 |
| C | 除去CaCO3中的Na2CO3 | 溶解、加入BaCl2溶液 | 复分解反应 |
| D | 除去NaCl中的Na2CO3 | 加入适量盐酸、蒸发 | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃的下列溶液中,碱性最强的是( )
A.pH=11的溶液
B.[OH-]=0.12 mol·L-1
C.1 L中含有4 g NaOH的溶液
D.[H+]=1×10-10 mol·L-1的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为10 mL一定物质的量浓度的HCl溶液用一定物质的量浓度的NaOH溶液滴定的图示。请根据图示计算:
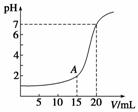
(1)氢氧化钠溶液物质的量浓度是多少?
(2)A点时溶液的pH是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
暗紫色化合物A具有绿色、高电压和高能量
的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在
水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A
进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫
酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,
得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ▲ ;化合物A与H2O反应的离子方程式为 ▲ 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是 ▲ 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 ▲ 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是 ▲
A.亚硫酸钠 B.KOH C.醋酸 D.Fe(NO3)3
(5)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质间的转化关系中不能全部通过一步反应完成的是
A.Na→NaOH→Na2CO3→NaCl B.Mg→MgCl2→MgCO3→Mg(OH)2
C.Al→Al2O3→Al(OH)3→AlCl3 D.Fe→FeCl3→Fe(OH)3→Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+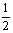 O2(g)
O2(g)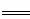 FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s
Fe(s )+CO2(g) △H= 。
)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如右下图所示,其中P端通入CO2。
①石墨I电极上的电极反应式为 。
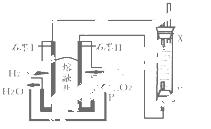 ②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化
为 ,
该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式中,不正确的是( )
A.Ba(OH)2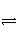
 Ba2++2OH-
Ba2++2OH-
B.NH3·H2O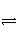
 NH
NH +OH-
+OH-
C.CH3COOH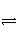
 CH3COO-+H+
CH3COO-+H+
D.AgCl===Ag++Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com