
| A. | 前者大于后者 | B. | 前者小于后者 | C. | 相等 | D. | 不能确定 |
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂△}^{O_{2}}$NO$→_{H_{2}O}^{O_{2}}$HNO3 | |
| B. | 浓HCl$→_{△}^{MnO_{2}}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | Al2O3$\stackrel{HCl(aq)}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$\stackrel{电解}{→}$Al | |
| D. | 淀粉$→_{△}^{H_{2}SO_{4}(aq)}$葡萄糖$\stackrel{酒化酶}{→}$C2H5OH$→_{Ag,△}^{O_{2}}$CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其最简单气态氢化物的稳定性小于(填“大于”或“小于”)NH3.
,其最简单气态氢化物的稳定性小于(填“大于”或“小于”)NH3.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
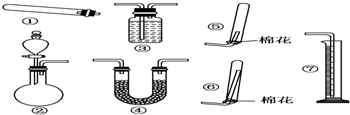
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;
;反应②的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
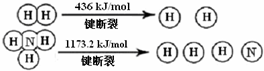
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.2mol•L-1•min-1 | B. | v(NO2)=0.2mol•L-1•min-1 | ||
| C. | v(H2O)=0.005mol•L-1•s-1 | D. | v(N2)=0.005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
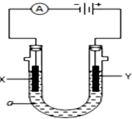
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 用惰性电极电解氯化钠溶液:4Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cl2↑+2H2↑+O2↑ | |
| C. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| D. | NaHCO3溶液中与滴加少量Ca(OH)2溶液:CO32-+Ca2+═CaCO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com