
 平衡原理探究题
平衡原理探究题| 滴加试剂及量 | 所根据的现象 | 结论 |
| 是盐水解之故 |
分析 (1)由正反应开始建立平衡,B的起始浓度最大,由逆反应开始建立平衡,B的起始浓度最小,据此计算;结合选项运用平衡移动原理分析解答;
(2)K2CO3 溶液中的碳酸根离子易水解显碱性,向红色溶液中加入足量BaCl2溶液,生成碳酸钡沉淀,根据颜色的变化分析;
(3)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;pH值变化相同,醋酸参加反应的氢离子比盐酸多.
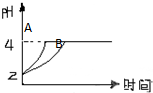
解答 解:(1)由正反应开始建立平衡,B的起始浓度最大,B的浓度变化量为4mol/L×$\frac{1}{2}$=2mol/L,故B浓度最大值为7mol/L+2mol/L=9mol/L,
由逆反应开始建立平衡,B的起始浓度最小,B的浓度变化=2△c(A)=2mol/L×2=4mol/L,故B的浓度最小值为7mol/L-4mol/L=3mol/L,故B的起始浓度c(B)的取值范围是3 mol/L≤c(B)≤9 mol/L;
若改变条件重新达到平衡后体系中C的质量分数增大,应使平衡向正反应方向移动,
A.增加C的物质的量,等效为增大压强,平衡向逆反应方向移动,C的质量分数降低,故A错误;
B.加压,平衡向逆反应方向移动,C的质量分数降低,故B错误;
C.升温,平衡向正反应方向移动,C的质量分数增大,故C正确;
D.使用催化剂,平衡不移动,C的质量分数不变,故D错误;
故答案为:3 mol/L≤c(B)≤9 mol/L;C;
(2)酚酞遇碱变红色,该溶液呈红色说明是碱性溶液,要验证该溶液遇酚酞是由于水解造成的,可用以下方法,向红色溶液中加入足量BaCl2溶液,如果溶液红色褪去,说明是盐水解的原因,故答案为:
| 滴加试剂及量 | 所根据的现象 | 结论 |
| 足量BaCl2溶液 | 红色褪去 | 是盐水解之故 |
点评 本题考查较为综合,涉及弱电解质的电离、化学平衡、难溶电解质的溶解平衡、盐类水解等知识点,难度较大,弱电解质的电离平衡、化学平衡是高考的热点,应熟练掌握.


科目:高中化学 来源: 题型:解答题
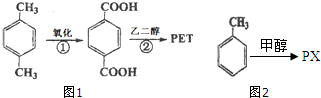 对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET).国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口.以PX为主要原料生产PET的一种路线如图1:
对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET).国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口.以PX为主要原料生产PET的一种路线如图1: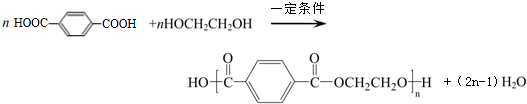 .(不用注明条件)
.(不用注明条件)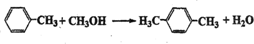 .(不用注明条件)
.(不用注明条件)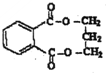 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在室内种植芦荟、常青藤等绿色植物 | |
| B. | 随意对室内装饰 | |
| C. | 不要紧闭门窗,注意经常保持通风 | |
| D. | 室内有异味时,要即时多喷洒香水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与溴水发生取代,反应产物的结构简式是CH3CBr2CH3 | |
| B. | 一定条件下能与水加成,产物是混合物 | |
| C. | 一定条件下能加聚合成 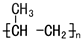 | |
| D. | 丙烯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -241.8 kJ•mol-1 | B. | -20.6kJ•mol-1 | C. | +29.7kJ•mol-1 | D. | +99.7 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe-3e-=Fe3+ | B. | 2Fe+2H2O+O2=2Fe(OH)2↓ | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳的电子式: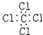 | |
| B. | 镁的原子结构示意图为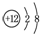 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+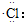 →H+[ →H+[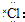 ]- ]- | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com