
| A. | Cu是氧化剂 | B. | FeCl3是还原剂 | ||
| C. | Cu在反应中失去电子 | D. | FeCl3发生氧化反应 |
分析 Cu+2FeCl3=2FeCl2+CuCl2反应中Cu元素的化合价升高,Fe元素的化合价降低,结合氧化还原反应的概念分析.
解答 解:A.Cu+2FeCl3=2FeCl2+CuCl2反应中Cu元素的化合价升高,Cu被氧化,则Cu作还原剂,故A错误;
B.Cu+2FeCl3=2FeCl2+CuCl2反应中Fe元素的化合价降低,FeCl3是氧化剂,故B错误;
C.反应中Cu元素的化合价升高,Cu在反应中失去电子,故C正确;
D.反应中Fe元素的化合价降低,Fe元素被还原,发生还原反应,故D错误.
故选C.
点评 本题考查氧化还原反应,注意根据元素化合价的变化分析,侧重考查学生分析、推断能力,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 炼铁是铁矿石在高温下被氧化的过程 | |
| D. | 钴的制备:3Co3O4+8Al$\stackrel{高温}{→}$9Co+4Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
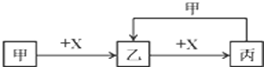
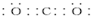 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程只有O2生成,共6.72 L的气体(标况) | |
| B. | 本过程一共涉及了三个化学反应 | |
| C. | 最终得到氢氧化铝的沉淀 | |
| D. | 最终得到的溶液中c(NaCl)=0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
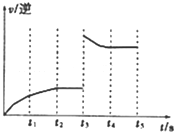 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com