
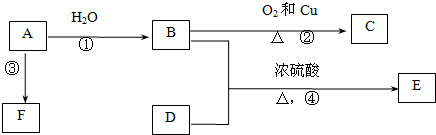
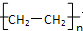 ,据此分析解答.
,据此分析解答.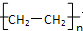 ,
,| Cu |
| △ |
| Cu |
| △ |
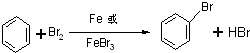 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、中和滴定实验时,用待测液润洗锥形瓶 |
| B、盛放NaOH溶液时,使用带玻璃瓶塞的磨口瓶 |
| C、在用PH试纸测溶液的pH值时,用镊子夹取试纸伸到试剂瓶中取液,将颜色与标准比色卡对照,读出数值 |
| D、向纯碱溶液加入酚酞,溶液显红色,将该溶液加热,则红色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
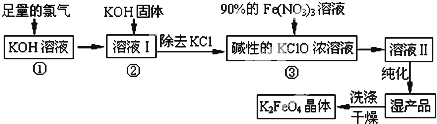
查看答案和解析>>
科目:高中化学 来源: 题型:
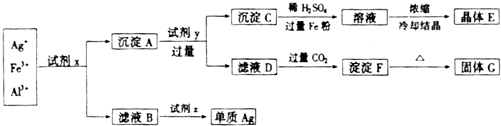
查看答案和解析>>
科目:高中化学 来源: 题型:
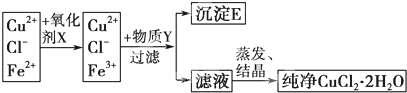
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度(℃) | 10 | 20 | 30 | 40 | 50 |
| 溶解度 | 36 | 48 | 60 | 73 | 87 |
查看答案和解析>>
科目:高中化学 来源: 题型:
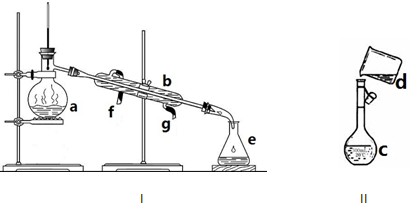
查看答案和解析>>
科目:高中化学 来源: 题型:
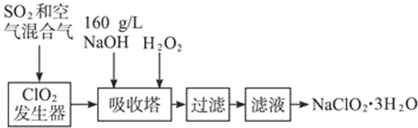
查看答案和解析>>
科目:高中化学 来源: 题型:
| v2o5 |
| △ |
| A、催化剂V2O5不改变该反应的逆反应速率 | ||
| B、增大反应体系的压强,反应速率一定增大 | ||
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 | ||
D、在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率v=
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com