
下列装置的线路接通后,经过一段时间,溶液的pH值明显下降的是( )
|
| A. |
稀H2SO4 | B. |
NaOH溶液 | C. |
NaCl溶液 | D. |
CuSO4溶液 |
|
| E. |
CuSO4溶液 |
|
|
|
|
|
|
考点:
原电池和电解池的工作原理.
专题:
电化学专题.
分析:
线路接通后,经过一段时间,溶液的pH值明显下降,说明该溶液中氢离子浓度增大,溶液的酸性增大,据此分析解答.
解答:
解:A.该装置中Cu电极上反应为2H++2e﹣=H2↑,该溶液中氢离子浓度减小,溶液的pH增大,故A错误;
B.该装置中电池反应式为Cu+2H2O Cu(OH)2↓+H2↑,溶液体积减小,氢氧根离子浓度增大,溶液的pH增大,故B错误;
Cu(OH)2↓+H2↑,溶液体积减小,氢氧根离子浓度增大,溶液的pH增大,故B错误;
C.电池反应式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,溶液中有NaOH生成,溶液的pH增大,故C错误;
2NaOH+Cl2↑+H2↑,溶液中有NaOH生成,溶液的pH增大,故C错误;
D.电池反应式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4,溶液酸性增强,pH减小,故D正确;
2Cu+O2↑+2H2SO4,溶液酸性增强,pH减小,故D正确;
E.该装置为电镀池,溶液中离子浓度不变,溶液的pH不变,故E错误;
故选D.
点评:
本题考查了原电池和电解池原理,明确各个装置发生的电池反应是解本题关键,再结合溶液中氢离子或氢氧根离子浓度变化分析解答,题目难度不大.


科目:高中化学 来源: 题型:
室温下测得甲醛、乙醛和丙酮组成的液态混合物中氢元素的质量分数为9.8%,则该混合物的平均相对分子质量为()
A. 50 B. 49 C. 51 D. 44
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 单质铯的熔点比单质锂的高 |
|
| B. | 胶体的胶粒不能通过滤纸 |
|
| C. | 元素N的氢化物的沸点比元素P的氢化物的沸点低 |
|
| D. | 用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)( )
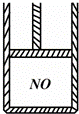
|
| A. | 等于1.369g•L﹣1 |
|
| B. | 等于2.054g•L﹣1 |
|
| C. | 在1.369g•L﹣1和2.054g•L﹣1之间 |
|
| D. | 在2.054g•L﹣1和4.108g•L﹣1之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在某容积可变的密闭容器中,有下列的可逆反应:A(g)+B(g)⇌xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线.若试判断对图2的说法中正确的是( )
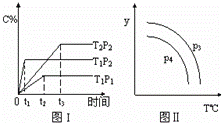
|
| A. | P3>P4,y轴表示C的体积分数 |
|
| B. | P3<P4,y轴表示B的质量分数 |
|
| C. | P3<P4,y轴表示混合气体的密度 |
|
| D. | P3>P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有 和 .
(2)元素周期表共有7周期,16族;同一周期元素的原子 相同.
(3)在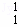 H、
H、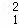 H、
H、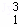 H、
H、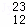 Mg、
Mg、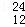 Mg和
Mg和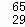 Cu中共有 种元素, 种原子.
Cu中共有 种元素, 种原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是()
A. 0.10 mol/L Ag+ B. 0.20 mol/L Zn2+
C. 0.20 mol/L Cu2+ D. 0.20 mol/L Pb2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com