
 (1)1mol O2与足量氢气反应产生水蒸气放热483.6kJ,若1g水蒸气转化成液态水放热2.444kJ,请写出表示氢气燃烧热的热化学方程式:
(1)1mol O2与足量氢气反应产生水蒸气放热483.6kJ,若1g水蒸气转化成液态水放热2.444kJ,请写出表示氢气燃烧热的热化学方程式:| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
 ,为加成聚合反应;
,为加成聚合反应; ,加成聚合反应;
,加成聚合反应;
| ||
| 4s |
| (1.5x)3 |
| (4-x)2(2-0.5x) |
| 2.284mol/L |
| 4mol/L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
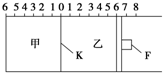 如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol SO2和1mol O2,乙中充入2mol SO3和1mol He,此时K停在0处.在一定条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),反应达到平衡后,再恢复至原温度.回答下列问题:
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol SO2和1mol O2,乙中充入2mol SO3和1mol He,此时K停在0处.在一定条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),反应达到平衡后,再恢复至原温度.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com