
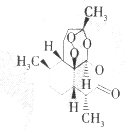
 中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )
中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素是芳香族化合物 | |
| C. | 青蒿素分子中含有过氧链、酯基和醚键 | |
| D. | 青蒿素不能发生加成反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
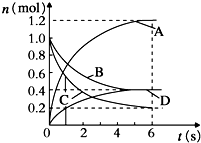
| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的反应速率相等 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
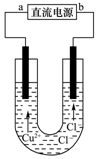
| A. | a端是直流电源的正极 | |
| B. | 阴极上发生的反应:Cu2++2e-=Cu | |
| C. | 通电使CuCl2发生电离 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用0.1mol•L-1的盐酸滴定0.1mol•L-1的氨水时,可用酚酞作指示剂 | |
| B. | 0.2 mol•L-1的醋酸与0.1 mol•L-1的氢氧化钠溶液等体积混合,所得溶液中:c(CH3COO-)+c(OH-)=C(CH3COOH)+C(H+) | |
| C. | pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中有水电离出的C(H+)=1×10-7 mol•L-1 | |
| D. | pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中C(NH3•H2O)>C(NH4+)>C(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 肯定含有Na+ | ||
| C. | 肯定不含SO42-肯定含有SO32- | D. | 不能肯定是否含有SO42 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
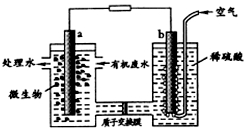 某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是( )| A. | a 电极发生反应:H2NCH2CH2NH2+16e-+4H2O═2CO2↑+N2↑+16H+ | |
| B. | 质子交换膜处H+由右向左移动 | |
| C. | 该电池在微生物作用下将化学能转化为电能 | |
| D. | 开始放电时b极附近pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com