
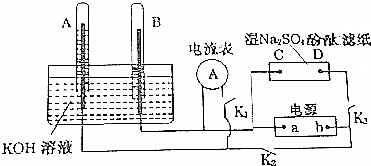
分析 A,B中充满KOH溶液,实验时,断开K1,闭合K2、K3,惰性电极电解KOH溶液,实质就是电解水,所得产物为H2和O2,因为B试管中气体体积是A试管中的2倍,所以B中氢离子得电子生成氢气,电极反应式为4H++4e=2H2↑,A中氢氧根离子失电子生成氧气和水,电极反应式为4OH--4e=2H2O+O2↑,即B为阴极,A为阳极,所以b为正极,a为负极,C为阴极,D为阳极,C极发生4H++4e=2H2↑,D极发生4OH--4e=2H2O+O2↑,以此解答该题.
解答 解:A,B中充满KOH溶液,实验时,断开K1,闭合K2、K3,惰性电极电解KOH溶液,实质就是电解水,所得产物为H2和O2,因为B试管中气体体积是A试管中的2倍,所以B中氢离子得电子生成氢气,电极反应式为4H++4e=2H2↑,A中氢氧根离子失电子生成氧气和水,电极反应式为4OH--4e=2H2O+O2↑,即B为阴极,A为阳极,所以b为正极,a为负极,C为阴极,D为阳极,C极发生4H++4e=2H2↑,D极发生4OH--4e=2H2O+O2↑,
(1)由以上分析可知,电源的a极为负极,故答案为:负;
(2)C连接电源的负极,为电解池的阴极,发生4H++4e=2H2↑,故答案为:4H++4e=2H2↑;
(3)①电极A连接电源的正极,为电解池的阳极,发生氧化反应,故正确;
②电子不通过溶液,故错误;
③电解时阴离子向阳极移动,D为阳极,则片刻后D点附近c(SO42-)增大,故正确;
④C为阴极,发生4H++4e=2H2↑,促进水的电离,OH-浓度增大,片刻后可观察到滤纸C点变红色,故正确.
故答案为:②.
点评 本题为电化学知识的综合应用,考查了原电池、电解池工作原理,注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,注意正确书写电极方程式,准确判断两极上离子的放电顺序,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: Ⅰ:C(s)+H2O(g)═CO(g)+H2(g) K1 Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2 Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 V:CaCO3(s)═CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com