
【题目】同温同压下,A容器中H2和B容器中NH3所含原子数相等,则两个容器的体积比是( )
A.3∶2B.1∶3C.2∶1D.1∶2
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤造成空气污染. 
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K= .
向一个10L的密闭容器中充入10mol CO2和7molH2 , 830℃时测得H2为lmol,此时V (正)V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是 .
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2 , 同时消耗1mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2 , 在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s)+CO2(g)FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15.下列说法正确的是( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K= ![]()
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3: Si+3HC1![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)①中制取粗硅的化学方程式:_____________________。
(2)粗硅与HCl 反应完全后,经冷凝得到的SiHCl3 (沸点33.0℃) 中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为______________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
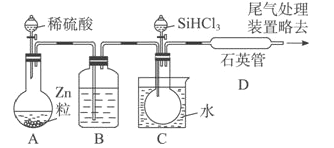
①装置B中的试剂是浓硫酸。装置C 中的烧瓶需要加热,其目的是____________。
②装置D中发生反应的化学方程式为____________。
③为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN 溶液 e.Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法中不正确的是( )
A. 在粗硅的提取中发生反应2C+SiO2![]() 2CO+Si,硅元素被还原
2CO+Si,硅元素被还原
B. 太阳能电池可采用硅材料制作,其应用有利于环保、节能
C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D. 由Na2CO3+SiO2![]() CO2+Na2SiO3可知硅酸的酸性强于碳酸
CO2+Na2SiO3可知硅酸的酸性强于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与100mL 18.5molL-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲35.84L(标准状况)。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1 mol/L,下列叙述不正确的是( )
A. 反应中共消耗1.8molH2SO4
B. 气体甲中SO2与H2的体积比为7:1
C. 反应中共消耗1.6molZn
D. 反应中共转移3.2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组第Ⅰ栏中的化学反应与第Ⅱ栏中的化学反应,都可以用第Ⅲ栏中的离子方程式表示的是( )
选项 | 第Ⅰ栏 | 第Ⅱ栏 | 第Ⅲ栏 |
A | 向AlCl3溶液中加入少量的NaOH溶液 | 向AlCl3溶液中加入过量的NaOH溶液 | Al3++4OH-===AlO |
B | 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 | Fe3++3OH-===Fe(OH) 3↓ |
C | 往NaHCO3溶液中滴入少量 Ca(OH)2溶液 | 往Ca(HCO3)2溶液中加入过量NaOH溶液 | Ca2++2OH-+2HCO ===CaCO3↓+CO |
D | 往Na2SiO3溶液中通入过量CO2气体 | 往Na2SiO3溶液中通入少量CO2气体 | SiO32-+CO2+H2O=CO32-+H2SiO3↓ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断:
(1)写出下列化学式AI
(2)G转化为I的现象为
(3)F+M→H离子方程式为
(4)A+X→C+D的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯化钠溶液、Fe(OH)3胶体和泥水三种分散系,下列叙述正确的是
A.Fe(OH)3胶体能产生丁达尔效应
B.最稳定的分散系是Fe(OH)3胶体
C.氯化钠溶液和Fe(OH)3胶体中的分散质都能透过半透膜
D.Fe(OH)3胶体的分散质粒子直径均小于1nm
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com