
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为:
H2O2+I-→H2O+IO- 慢
H2O2+IO-→H2O+O2+I- 快
下列有关该反应的说法正确的是( )
A.反应速率与I-浓度无关
B.IO-也是该反应的催化剂
C.分解2mol H2O2放出热量196kJ
D.v(H2O2)=v(H2O)=v(O2)
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】化合物PH4I是一种白色晶体,受热不稳定,易分解产生PH3。PH3是无色剧毒气体, 广泛用于半导体器件和集成电路生产的外延、离子注入和掺杂。
(1)在2L真空密闭容器中加入一定量PH4I固体,T1℃ 时发生如下反应: PH4I(s) PH3(g) + HI(g)
①下列可以作为反应达到平衡的判据是_____。
A.容器内气体的压强不变
B.容器内 HI 的气体体积分数不变
C.容器内 PH4I 质量不变
D.容器内气体的密度不变
E.容器内气体的平均相对分子质量不变
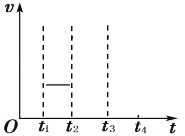
②t1时刻反应达到平衡后,在t2时刻维持温度不变瞬间缩小容器体积至1L,t3时刻反应重新达到 平衡。在下图中画出t2~t4 时段的υ正、υ逆随时间变化图______。
(2)PH4I固体分解产生的PH3和HI均不稳定,在一定温度下也开始分解。在2L真空密闭容器中加 入一定量PH4I固体,已知在T2℃ 时存在如下反应:
Ⅰ PH4I(s) PH3(g) + HI(g) ΔH1
Ⅱ 4 PH3(g) P4(g) + 6 H2(g) ΔH2
Ⅲ 2 HI(g) H2 (g) + I2(g) ΔH3
①已知:298K,101kPa,H-P键、P-P键、H-H键的键能分别为322 kJ·mol-1、200 kJ·mol-1、436 kJ·mol-1试计算ΔH2 =______________。
②各反应均达平衡时,测得体系中 n(PH3)=a mol ,n(P4)=b mol ,n(H2)=c mol ,则 T2℃时 反应I的平衡常数K值为___________________。(用a、b、c表示)
③维持温度不变,缩小体积增大压强,达到新的平衡后,发现其它各成分的物质的量均发生变化,而n(I2)基本不变,试解释可能原因_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。

(1)当反应进行到第_______min,该反应达到平衡。
(2)计算X的转化率______。
(3)计算反应从开始至2分钟末,Z物质的化学反应速率______。
(4)由图中所给数据进行分析,该反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
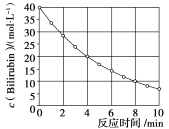
【题目】化合物![]() 在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应在4-8min内的平均反应速率和推测反应16min时反应物的浓度,结果应是( )
在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应在4-8min内的平均反应速率和推测反应16min时反应物的浓度,结果应是( )
A.![]() 和2.0mol/L
和2.0mol/L
B.![]() 和2.5mol/L
和2.5mol/L
C.![]() 和3.0mol/L
和3.0mol/L
D.![]() 和3.0mol/L
和3.0mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KMnO4酸性溶液处理硫化亚铜(Cu2S)和二硫化亚铁(FeS2)的混合物时,发生的反应Ⅰ:![]() +Cu2S+H+→Cu2++
+Cu2S+H+→Cu2++![]() +Mn2++H2O(未配平)和反应Ⅱ:
+Mn2++H2O(未配平)和反应Ⅱ:![]() +FeS2+H+→Fe3++
+FeS2+H+→Fe3++![]() +Mn2++H2O(未配平)。下列说法正确的是( )
+Mn2++H2O(未配平)。下列说法正确的是( )
A.反应Ⅰ中Cu2S既是氧化剂又是还原剂
B.反应Ⅰ中每生成1mol![]() ,转移电子的物质的量为10mol
,转移电子的物质的量为10mol
C.反应Ⅱ中氧化剂与还原剂的物质的量之比为1:3
D.若反应Ⅰ和反应Ⅱ中消耗的KMnO4的物质的量相同,则反应Ⅰ和反应Ⅱ中消耗的还原剂的物质的量之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图,下列有关该电池的说法正确的是
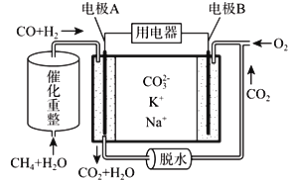
A. 反应CH4+H2O![]() 3H2+CO消耗1mol CH4转移4mol电子
3H2+CO消耗1mol CH4转移4mol电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于一定条件下的化学平衡H2(g)+I2(g)![]() 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
A.恒温恒容,充入H2,v(正)增大,平衡右移
B.恒温恒容,充入He,v(正)增大,平衡右移
C.加压,v(正),v(逆)不变,平衡不移动
D.升温,v(正)减小,v(逆)增大,平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
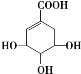
A.分子式为C7H10O5,属于芳香族化合物,易溶于水
B.分子中含有3种官能团,可以发生加成、氧化、取代等反应
C.在水溶液中,1mol莽草酸最多可电离出4molH+
D.1mol莽草酸与足量的NaHCO3溶液反应可放出4molCO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡唑类化合物是重要的医用中间体,如图是吡唑类物质L的合成路线。
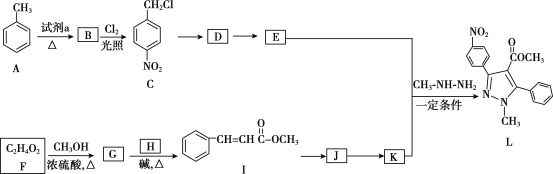
已知:R1—CHO+R2CH2—COOR3![]()
R1—CHO+R2NH2![]() R1—CH=N—R2
R1—CH=N—R2
(1)试剂a是__。
(2)C生成D的反应类型是__。
(3)D生成E的化学方程式是___。
(4)生成G的化学方程式是__。
(5)H的结构简式是__。
(6)写出符合下列条件的I的同分异构体的结构简式__。
a.是反式结构
b.能发生银镜反应
c.苯环上的一氯代物有2种
d.1mol该有机物能与2mol氢氧化钠反应
(7)K的分子式是C10H8O2,K的结构简式是__。
(8)以2-甲基丙烯和乙酸为原料,选用必要的无机试剂,合成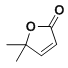 ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com