
| A、①③⑥ | B、②③⑥ |
| C、②④⑥ | D、②④⑤⑥ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Al、NaCl |
| B、H2、Al(OH)3 |
| C、H2、NaCl、NaAlO2 |
| D、H2、NaCl、Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、CO32-、Ag+、SO42- |
| B、Na+、Cu2+、SO42-、Cl- |
| C、NO3-、Na+、MnO4-、K+ |
| D、Ca2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、CO的燃烧热为283 kJ |
B、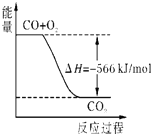 如图可表示由CO生成CO2的反应过程和能量关系 |
| C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol |
| D、CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为1.204×1024个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①=④>③=② |
| B、④=①>③>② |
| C、①>④>③>② |
| D、④>①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾溶液中加入过量的氨水A13++4NH3?H20=AlO2-+4NH4++2H2O | ||
| B、在FeI2溶液中滴入少量溴水2Fe2++4I-+3Br2=2Fe3++2I2+6Br- | ||
C、碳酸钠溶液中逐滴加入与之等物质的量的盐酸:CO
| ||
| D、乙酸溶液中加入少量碳酸氢铵溶液CH3COOH+HCO3-=CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.4 mL |
| B、5.6 mL |
| C、4.2 mL |
| D、2.8 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com