
【题目】下列涉及有机物的说法正确的( )
A.乙烯、氯乙烯、苯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.丙烷是一种清洁燃料,可用作燃料电池的燃料
C.苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴
D.糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝两种工艺流程如下:
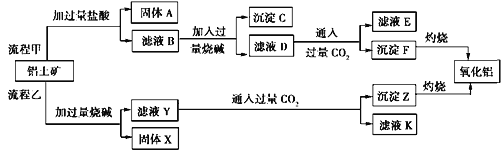
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
请回答下列问题:
(1)验证滤液B含Fe3+,可取少量滤液并加入__________(填试剂名称)。
(2)滤液E、K中溶质的主要成份是________(填化学式),写出该溶质的一种用途____________。
(3)流程甲加入盐酸后生成Al3+的离子方程式为________。
(4)流程乙加入烧碱后生成SiO![]() 的离子方程式为____________________________。
的离子方程式为____________________________。
(5)滤液D中通过量CO2产生沉淀F的离子方程式:___________________________。
(6)已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13,则此温度下残留在溶液中的c(Mg2+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2(T2>T1)时,Y的体积分数(或Y的物质的量分数)与时间的关系如图2所示。则下列结论正确的是( )
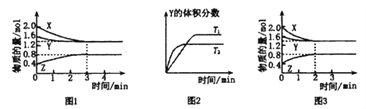
A. 容器中发生的反应可表示为:4X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应进行的前3min内,用X表示的反应速率v(X)=0.3mol/(L·min)
C. 升高温度,反应的化学平衡常数K增大
D. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为 0.1 molL-1、体积均为 100 mL 的两种一元酸 HX、HY的溶液中,分别加入 NaOH固体,lg[c(H+ )/c(OH- )]随加入 NaOH的物质的量的变化如图所示。下列说法正确的是

A. 常温下电离常数:HX < HY![]()
B. a 点由水电离出的 c(H+)=10-12 molL-1
C. c 点溶液中:c(Y- )>c(HY )![]()
D. b 点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组合中,能大量共存的是
A. Cu2+、Mg2+、OH-、SO42- B. H+、Ag+、Cl-、NO3-
C. Na+、K+、SO42-、Cl- D. Ba2+、H+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是常见的过渡金属之一,研究铬的性质具有重要意义。
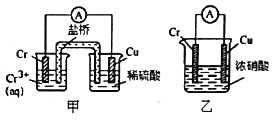
(1)在上图装置中,观察到装置甲铜电极上产生大量的无色气体;而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论_______________。
(2)工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为_____。

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(VI)转化为Cr(III)常见的处理方法是电解法和铁氧磁体法。
①电解法:将含Cr2O72-的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaC1进行电解,使阳极生成的Fe2+和Cr2O72-发生反应,其离子方程式为___________。阴极上Cr2O72-、H+、Fe3+都可能放电。若Cr2O72-放电,则阴极的电极反应式为_________;若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀。
②铁氧磁体法:在含Cr(VI)的废水中加入绿矾,在pH<4时发生反应使Cr(VI)转化为Cr(III),调节溶液pH为6~8,使溶液中的Fe(I)、Fe(Ⅱ)、Cr(III)析出组成相当于Fe(Ⅱ)[Fe(III)x·Cr (III)2-x]O4(铁氧磁体 的沉淀,则铁氧磁体中x=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据叙述,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为_____________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________________________________________________________________________。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为_______________。
(4)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为______________。
(5)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知: N2(g)+2O2(g)==2NO2(g) ΔH1=+67.2kJ/mol N2H4(g)+O2(g)==N2(g)+2H2O(l) ΔH2=-534kJ/mol假如都在相同状态下,请写出发射火箭反应的热化学方程式。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系的压强不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A. ③④⑤⑥B. ①③④⑥C. ②③④⑥D. ①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com