
氮的氧化物对人体危害极大,试验时应防止其对空气的污染。
实验一:某同学利用下列装置实现铜与浓硝酸、稀硝酸的反应。
I. 取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3].
II. 将洗涤后的铜丝做成匝数较多的螺旋状。
III. 按如图所示装置连接仪器、检查气密性、装入化学试剂。
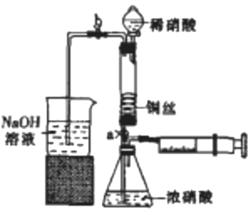
(1) 请完成过程I发生反应的离子方程式:Cu2(OH)2CO3+4H+=_____________.
(2) 过程III的后续操作如下:
①为使浓硝酸与铜丝接触,操作是打开止水夹a和b,__________________.当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器。生成红棕色气体的化学方程式是_______________________________.
②控制b和分液漏斗活塞,玻璃管充满硝酸时,关闭b打开a,可见有无色气体产生。稀硝酸充满玻璃管的目的是___________________________.
实验二:NO2与水反应的实验探究。
(3) 将3支盛满红棕色气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响
 、
、
①根据上表得出的结论是温度越_______________(填“高”或“低”),进入试管中的溶液越多。
②查阅材料:a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+ HNO2、
3HNO2= HNO3+2NO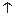 +H2O;HNO2不稳定,则产生上述现象的原因是________________.
+H2O;HNO2不稳定,则产生上述现象的原因是________________.
【知识点】实验设计 J1 J4
【答案解析】(1)2Cu2++ CO2↑+3H2O(2分)
(2)①从注射器中推入空气;Cu+4HNO3(浓)= Cu(NO3)2+2 NO2↑+2H2O(2分) ②将玻璃管中的NO2和空气排出(1分)
(3)①低(1分)
②温度低,HNO2分解量减少,分解产生的NO气体量减少,即生成的NO所占体积小,所以进入试管中的溶液多(2分)
解析:(1)用稀硫酸除去铜锈:Cu2(OH)2CO3+4H+=2Cu2++ CO2↑+3H2O
(2)①看图知需要增大锥形瓶内的压强才能使硝酸进入玻璃管与铜丝接触,所以操作是打开止水夹a和b从注射器中推入空气;浓硝酸进入玻璃管与铜丝接触发生反应:Cu+4HNO3(浓)= Cu(NO3)2+2 NO2↑+2H2O ②要得到无色气体的关键是排除装置内的空气,防止NO被氧化。
(3)①根据上表数据:水温是0摄氏度时液面上升高度最高,50摄氏度时液面上升高度最低,得出的结论是温度越低,进入试管中的溶液越多。
【思路点拨】本题考查了实验设计,在课本实验的基础上进行改进,我们要从压强的角度,结和气体性质解答。


科目:高中化学 来源: 题型:
下列说法错误的是 ( )
A.如果设“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的
B.不是所有反应,都遵循由强(如强酸、强碱、强氧化剂或强还原剂等)制弱(如弱酸、弱碱、弱氧化剂或弱还原剂等)的规律
C.不是所有自发进行的反应都一定是焓减少的过程
D.在迄今发现的元素中,不一定所有非金属元素(稀有气体除外)都满足条件“主族元素的族序数≥其周期序数”
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
| | |||
| A.将海带灼烧成灰 | B.过滤得含I-溶液 | C.萃取后放出碘 的CCl4溶液 | D.分离碘并回收CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
回答下列问题:
(1)A中生成氨气反应的化学方程式是_________________________________________;
(2)B中加入的干燥剂是_________(填序号)①浓硫酸②无水氯化钙 ③碱石灰;
(3)能证明氨与氧化铜反应的现象①C中______________、②D中有无色液体生成;
设计实验检验D中无色液的成分:取少量液体于试管中,加入少量________粉末,现象为___________________。
(4)写出氨气与氧化铜反应的化学方程式___________________________;若收集到2.24L(STP)氮气,计算转移电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2 kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
根据盖斯定律计算:已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为C(金刚石,s)+O2(g)===CO2(g) ΔH1=-395.41 kJ·mol-1,C(石墨,s)+O2(g)===CO2(g)
ΔH2=-393.51 kJ·mol-1,则金刚石转化为石墨时的热化学方程式为
________________________________________________________________________
________________________________________________________________________。
由此看来更稳定的碳的同素异形体为__________。若取金刚石和石墨的混合晶体共1 mol在O2中完全燃烧,产生热量为Q kJ,则金刚石和石墨的物质的量之比为_____________
_________(用含Q的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:在卡片上,描述合理的是( )
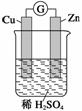

A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,某反应达到平衡,平衡常数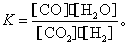 恒容时,温度升高,H2浓度减小。下列说法正确的是( )
恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为 CO+H2O CO2+H2
CO2+H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com