
 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )| A、假蜜环菌甲素可以发生消去反应 |
| B、1 mol假蜜环菌甲素可与 6 molH2发生加成反应 |
| C、假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 |
| D、假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:2014-2015学年山东省枣庄市高三1月月考理综化学试卷(解析版) 题型:实验题
(16分)黄铜矿的主要成分是CuFeS2(硫元素显—2价,铁元素显+2价)。实验室里用黄铜矿为原料制取单质铜和铁红(Fe2O3)的流程如下:

已知:CuFeS2+O2 Cu+FeS+ SO2 ,FeS+2HCl
Cu+FeS+ SO2 ,FeS+2HCl FeCl2+H2S。
FeCl2+H2S。
(1)在实验室中,应将黄铜矿粉末放在_____(填仪器名称)中焙烧。
(2)将反应过程中产生的SO2和H2S通入下图所示装置中检验它们的性质。该实验证明SO2具有_________性和__________性。

(3)欲选用下列部分装置在实验室中以MnO2和浓盐酸为原料制取纯净、干燥的氯气。
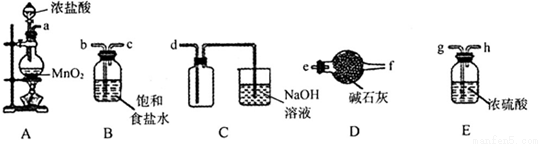
①圆底烧瓶中发生反应的离子方程式为_________________________________________。
②按气流方向由左到右,导管口连接顺序为a→________________________________。
③装置连接好后,需要进行的操作是_________________。
(4)若铁红Fe2O3样品中含有FeO,选用提供的试剂,设计实验验证铁红中含有FeO。写出有关实验操作、现象与结论。________________________________________________________。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO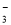 、AlO
、AlO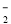 、K+、S2-等离子
、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中C(Na+)≥C(A-)
C.1 mol/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知草酸为二元弱酸:
已知草酸为二元弱酸:| A、pH=1.2溶液中:c(K+)+c(H+)=c(OH-)+c(H2C2O4) |
| B、pH=2.7溶液中:c2(HC2O4-)/[c(H2C2O4)×c(C2O42-)]=1000 |
| C、将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得pH为4.2的混合液 |
| D、向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一直增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- |
| D、无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com