
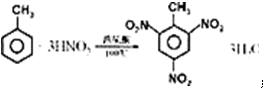
·ÖĪö £Ø1£©Éę¼°µ½µÄ»Æѧ·½³ĢŹ½ÓŠ¢Ł2Na+2HCl=2NaCl+H2”ü£¬¢ŚMg+2HCl=MgCl2+H2”ü£¬¢Ū2Al+6HCl=2AlCl3+3H2”ü£¬¾ŻĢāÄæøųµÄĮæ½įŗĻ·½³ĢŹ½½ųŠŠ¼ĘĖć£»
£Ø2£©Na2CO3ŗĶNaHCO3ŠŌÖŹ²»Ķ¬£ŗ¢ŁNaHCO3ŹÜČČ·Ö½ā£¬¢ŚĢ¼ĖįøĘÄŃČÜÓŚĖ®£¬¶ųĢ¼ĖįĒāøĘČÜÓŚĖ®£¬¢ŪNaHCO3ÓėŃĪĖį·“Ó¦¾ēĮŅ£¬¢Ü¶¼ÄܳĪĒåŹÆ»ŅĖ®·“Ӧɜ³ÉĢ¼ĖįøĘ³Įµķ£¬¾Ż“Ė½ųŠŠ·ÖĪö£»
£Ø3£©¾ŻNa2CO3+2HCl=2NaCl+H2O+CO2”ü£¬NaHCO3+HCl=NaCl+H2O+CO2”ü£¬ÖŠ²śÉśĘųĢåĢå»ż£¬ĒóHClµÄĪļÖŹµÄĮæÖ®±Č£»¶žÕߵĹĢĢåÖŹĮæÖ®±Č£®
½ā“š ½ā£ŗ£Ø1£©2Na+2HCl=2NaCl+H2”ü
46 22.4
23 11.2
Ōņ£ŗV£ØH2£©=11.2L£¬
Mg+2HCl=MgCl2+H2ӟ
24 22.4
24 22.4
Ōņ£ŗV£ØH2£©=22.4L£¬
2Al+6HCl=2AlCl3+3H2ӟ
54 67.2
27 33.6
Ōņ£ŗV£ØH2£©=33.6L£¬¹Ź²śÉśĒāĘųµÄĢå»żÖ®±Č11.2£ŗ22.4£ŗ33.6=1£ŗ2£ŗ3£¬
¹Ź“š°øĪŖ£ŗ1£ŗ2£ŗ3£»
£Ø2£©A£®Na2CO3ŹÜČČ²»·Ö½ā£¬¶ųNaHCO3ŹÜČČ·Ö½ā£¬²śÉśµÄĘųĢåŹ¹³ĪĒåµÄŹÆ»ŅĖ®±ä»ė×Ē£¬æÉŅŌ¼ų±š£¬¹ŹAÕżČ·£»
B£®Na2CO3ÓėCaCl2ČÜŅŗ×÷ÓĆ²śÉśCaCO3³Įµķ£¬¶ųNaHCO3Ōņ²»ÓėCaCl2ČÜŅŗ·“Ó¦£¬ĪŽ³Įµķ²śÉś£¬æÉŅŌ¼ų±š£¬¹ŹBÕżČ·£»
C£®ĻņNa2CO3ÖŠÖšµĪ¼ÓČėŃĪĖįŹ±£¬ĻČĪŽĘųĢå²śÉś£¬µ±ŃĪĖį¼ÓČė½Ļ¶ąŹ±£¬æɲśÉśĘųĢ壬¶ųĻņNaHCO3ÖŠ¼ÓČėĶ¬ÅضČŃĪĖį£¬ŌņŃøĖŁ²śÉśĘųĢ壬æÉŅŌĶعż²śÉśĘųĢåµÄæģĀż¼ÓŅŌ¼ų±š£¬¹ŹCÕżČ·£»
D£®Na2CO3ŗĶNaHCO3¾łæÉÓė³ĪĒåŹÆ»ŅĖ®·“Ó¦²śÉś³Įµķ£¬ĻÖĻóĻąĶ¬£¬ĪŽ·Ø¼ų±š£¬¹ŹD“ķĪó£»
¹Ź“š°øĪŖ£ŗABC£»
£Ø3£©n£ØCO2£©=$\frac{33.6L}{22.4L/mol}$=1.5mol£¬
Na2CO3+2HCl=2NaCl+H2O+CO2ӟ
106 2 1
159 3 1.5
Ōņ£ŗn£ØHCl£©=3mol£¬m£ØNa2CO3£©=159g£¬
NaHCO3+HCl=NaCl+H2O+CO2”ü£¬
84 1 1
126 1.5 1.5
Ōņ£ŗn£ØHCl£©=1.5mol£¬m£ØNaHCO3£©=126g£¬
¹ŹHClµÄĪļÖŹµÄĮæÖ®±ČĪŖ3£ŗ1.5=2£ŗ1£¬¶žÕߵĹĢĢåÖŹĮæÖ®±ČĪŖ159£ŗ126=53£ŗ42£¬
¹Ź“š°øĪŖ£ŗ2£ŗ1£»53£ŗ42£®
µćĘĄ ±¾ĢāĪŖ×ŪŗĻŠŌĢāÄ棬ÓČĘäŹĒ£Ø2£©æ¼²éĪļÖŹµÄ¼ų±š£¬ĢāÄæÄŃ¶Č²»“ó£¬×¢ŅāĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄʵĊŌÖŹµÄŅģĶ¬£¬Ń§Ļ°ÖŠ×¢ÖŲĻą¹Ų»ł“”ÖŖŹ¶µÄ»żĄŪ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓČČæɼÓæģ·“Ó¦ĖŁĀŹ | B£® | Ōö“óĻ”ĮņĖįµÄÅضČæɼÓæģ·“Ó¦ĖŁĀŹ | ||
| C£® | ·ŪĖéŠæĮ£æɼÓæģ·“Ó¦ĖŁĀŹ | D£® | ĢįøߊæµÄ“æ¶ČæɼÓæģ·“Ó¦ĖŁĀŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 60g±ū“¼ŗ¬ÓŠµÄ¹²¼Ū¼üŹżÄæĪŖ10NA | |
| B£® | ³£ĪĀ³£Ń¹ĻĀ£¬4.4gCO2ÓėN2O»ģŗĻĘųĢåÖŠŗ¬ÓŠµÄŌ×ÓŹżĪŖ0.3NA | |
| C£® | ŌŚ¹żŃõ»ÆÄĘÓėĖ®µÄ·“Ó¦ÖŠ£¬ĆæÉś³É0.1molŃõĘų£¬×ŖŅʵē×ӵďżÄæĪŖ0.4NA | |
| D£® | 80ml10mol/LŃĪĖįÓė×ćĮæMnO2¼ÓČČ·“Ó¦£¬²śÉśCl2µÄ·Ö×ÓŹżĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Čō¦Ń£Ø¼×£©£¼¦Ń£ØŅŅ£©£¬ŌņĘųĢåµÄŃ¹Ēæ£ŗ¼×£¾ŅŅ | B£® | Čō¦Ń£Ø¼×£©£¾¦Ń£ØŅŅ£©£¬Ōņ·Ö×ÓŹż£ŗ¼×£¾ŅŅ | ||
| C£® | Čō¦Ń£Ø¼×£©£¼¦Ń£ØŅŅ£©£¬ŌņĘųĢåĦ¶ūĢå»ż£ŗ¼×£¼ŅŅ | D£® | Čō¦Ń£Ø¼×£©£¾¦Ń£ØŅŅ£©£¬ŌņĘųĢåĢå»ż£ŗ¼×£¼ŅŅ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Č¼×ÅµÄ¾Ę¾«µĘ“ņ·Ź§»š£¬Į¢¼“ÓĆĖ®½½Ćš | |
| B£® | Čō²»É÷½«ÅؼīŅŗÕ“ŌŚĘ¤·ōÉĻ£¬Į¢¼“ÓĆ“óĮæĖ®³åĻ“£¬ŌŁĶæÉĻŹŹĮæµÄĻ”ÅšĖįČÜŅŗ | |
| C£® | ÓĆĒāĘų»¹ŌŃõ»ÆĶŹ±£¬ĻČ¼ÓČČŌŁĶØČėĒāĘų£¬ŅŌĆāĄĖ·ŃĒāĘų | |
| D£® | ÅäÖĘĻ”ĮņĖįŹ±£¬æÉĻČŌŚĮæĶ²ÖŠ¼ÓČėŅ»¶ØĮæµÄĖ®£¬ŌŁŌŚ½Į°čĻĀ»ŗĀż¼ÓČėÅØĮņĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
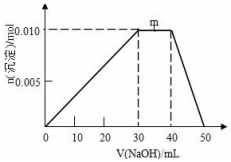 ĻņŹ¢ÓŠ10mL1mol•L-1 NH4Al£ØSO4£©2ČÜŅŗµÄÉÕ±ÖŠµĪ¼Ó1mol•L-1NaOHČÜŅŗ£¬³ĮµķĪļÖŹµÄĮæĖęNaOHČÜŅŗĢå»ż±ä»ÆŹ¾ŅāĶ¼ČēĻĀ£ŗ
ĻņŹ¢ÓŠ10mL1mol•L-1 NH4Al£ØSO4£©2ČÜŅŗµÄÉÕ±ÖŠµĪ¼Ó1mol•L-1NaOHČÜŅŗ£¬³ĮµķĪļÖŹµÄĮæĖęNaOHČÜŅŗĢå»ż±ä»ÆŹ¾ŅāĶ¼ČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 80g CuOŗĶCu2SµÄ»ģŗĻĪļÖŠ£¬Ėłŗ¬ĶŌ×ÓŹżĪŖNA | |
| B£® | 1mol NaBH4Óė×ćĮæĖ®·“Ó¦£ØNaBH4+H2O”śNaBO2+H2”ü£¬Ī“ÅäĘ½£©Ź±×ŖŅʵĵē×ÓŹżĪŖ4NA | |
| C£® | ³£ĪĀĻĀ£¬2L 0.1 mol•L-1FeCl3 ČÜŅŗÓė 1L 0.2 mol•L-1FeCl3 ČÜŅŗĖłŗ¬ Fe3+ŹżÄæ²»Ķ¬ | |
| D£® | 100gÖŹĮæ·ÖŹżĪŖ46%µÄŅŅ“¼ČÜŅŗÖŠŗ¬ÓŠNAøö-OH |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com