
【题目】向盛有KL溶液的试管中加入少许![]() 后滴加氯水,
后滴加氯水,![]() 层变成紫色。如果继续向试管中滴加氯水,振荡,
层变成紫色。如果继续向试管中滴加氯水,振荡,![]() 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平![]() 层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
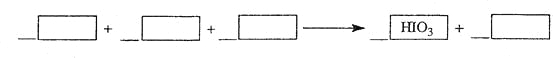 _____
_____
2)整个过程中的还原剂是___。
3)把KL换成KBr,则![]() 层变为__色:继续滴加氯水,
层变为__色:继续滴加氯水,![]() 层的颜色没有变化。
层的颜色没有变化。![]() 、
、![]() 、
、![]() 氧化性由强到弱的顺序是______。
氧化性由强到弱的顺序是______。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含![]() 的食盐)1000kg,若庄Kl与
的食盐)1000kg,若庄Kl与![]() 反应制
反应制![]() ,至少需要消耗
,至少需要消耗![]() ________L(标准状况,保留2位小数)。
________L(标准状况,保留2位小数)。
【答案】I2+5Cl2+6H2O→2HIO3+10HCl KI、I2 红棕 HbrO3、Cl2、HIO3 10.58
【解析】
(1)根据氧化还原反应方程式的配平原则,分析反应中的化合价变化,I元素的化合价从0→+5,升高5价,Cl元素的化合价从0→-1,降低1价,综合得失电子守恒和质量守恒,可配平出:I2+5Cl2+6H2O═2HIO3+10HCl;
(2)分析整个过程中化合价升高的都是I元素,还原剂为:KI和I2;
(3)KI换成KBr时,得到的是溴单质,则其在CCl4中呈红棕色;继续滴加氯水时,颜色不变,可知氯水不能将溴单质氧化成HBrO3,故其氧化性强弱顺序为:HBrO3>Cl2>HIO3;
(4)1000kg加碘食盐中至少含碘25.4g,KI+3Cl2+3H2O=KIO3+6HCl,根据KIO3~I~KI~3Cl2可知,则需要消耗标准状况下Cl2的体积为:![]() ×3×22.4L/mol=13.44L。
×3×22.4L/mol=13.44L。


科目:高中化学 来源: 题型:
【题目】下列实验的现象和结论都正确的是
实验 | 现象 | 结论 |
A.充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不能燃烧 | Na2SiO3可做防火剂 |
B.测定浓度均为0.1 mol·L-1的CH3COONa与HCOONa溶液的pH | CH3COONa溶液的pH较大 | 结合H+的能力: HCOO->CH3COO- |
C.某溶液中加浓NaOH溶液加热 | 产生能使湿润的蓝色石蕊试纸变红色的气体 | 原溶液中有 |
D.将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,向废液中加入Na2SO3溶液反应后进行分离除去CCl4,再向反应液中通入Cl2进行氧化、富集等系列操作获得碘单质。下列说法不正确的是:
A.加入Na2SO3溶液发生的氧化还原反应为:SO32-+I2+H2O=SO42-+2I-+2H+
B.氧化时应控制在较低温度(40℃左右),可增大Cl2的溶解度并减少I2的损失
C.分离除去CCl4的操作为萃取,应在分液漏斗中进行
D.工业上常在干海带浸泡液中通入适量氯气,再采用过滤的方法得到粗碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g)![]() CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g)△H=+41.2kJ·mol-1
H2O(g)+CO(g)△H=+41.2kJ·mol-1
(1)写出用CO2与H2反应制备甲醇的热化学方程式______________。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
升高温度,该平衡的移动方向是______________(填“正向”或“逆向”)。500℃时,CO和H2O的起始浓度均为0.020mol·L-1,该条件下CO的平衡浓度为:______________mol·L-1。
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示,该温度下的的平衡常数等于_______________。
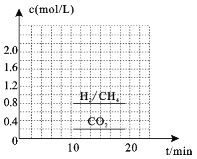
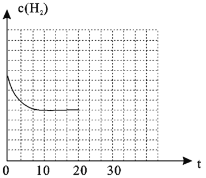
(4)若在20min时减小压强,并在30min时达到平衡状态,请在图2中画出H2的物质的量浓度随时间变化的图像__________________。
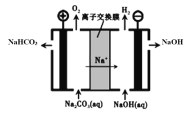
(5)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。请写出阳极的电极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测21世纪中叶将进入“氢能经济”时代,许多化合物或合金都是具有广阔应用前景的储氢材料。回答下列问题:
(1)基态Li原子核外电子有___种不同的运动状态,占据最高能层电子的电子云轮廓图形状为__。
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为__________。
(3)亚氨基锂(Li2NH) 中所含的元素,电负性由大到小排列的顺序是_________。
(4)咔唑(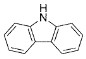 )的沸点比芴(
)的沸点比芴(![]() )高的主要原因是_______。
)高的主要原因是_______。
(5)NH3BH3 (氨硼烷,熔点104℃)与______(写出一种分子)互为等电子体。可通过红外光谱测定该分子的立体构型,NH3BH3中B的杂化轨道类型为________。
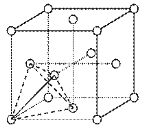
(6)一种储氢合金的晶胞结构如图所示。在晶胞中Cu原子处于面心,Au原子处于顶点位置。该晶体中,原子之间的作用力是_______。实现储氢功能时,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如图),若所有四面体空隙都填满,该晶体储氢后的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:
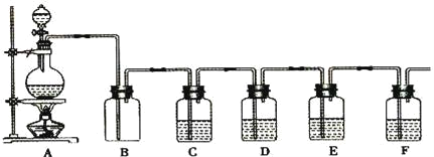
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作不能达到实验目的的是
A | B | C | D |
|
|
|
|
分离乙酸乙酯与饱和碳酸钠溶液 | 除去乙炔中的硫化氢 | 检验反应生成的气体中含有乙烯 | 酸性:醋酸>碳酸>硼酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g·cm-3) | 溶解性 | |
水 | 乙醇 | |||||
甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。

(1)装置a的名称是______________,为使反应体系受热比较均匀,可________。
(2)三颈瓶中发生反应的化学方程式为_______________________________________________________。
(3)写出苯甲醛与银氨溶液在一定的条件下发生反应的化学方程式:________________________________。
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过___________、__________(填操作名称)等操作,才能得到苯甲醛粗产品。
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸。若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是______________(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,不能证明乙酸是弱酸的实验事实是
A.0.1mol·L-1CH3COOH溶液pH>1
B.pH=1CH3COOH溶液稀释100倍,pH<3
C.CH3COOH溶液与Na2CO3反应生成CO2
D.0.1mol·L-1CH3COONa溶液的pH大于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com