


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
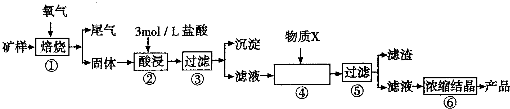
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取 | B、用升华法分离碘和氯化铵的混合物 | C、用NaOH溶液、蒸馏水和红色石蕊试纸检验溶液中是否含有NH4+ | D、以粗铜为阴极,精铜为阳极,CuSO4溶液为电解液,精炼铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ①C |
| 高温 |
| ②HCI |
| 300℃ |
| ③过量H2 |
| 1000~1100℃ |
| 物质 | SiHCl3 | SiCl4 | HCl |
| 沸点 | 33.0℃ | 57.6℃ | -84.7℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜与浓硫酸反应所得白色固体是CuSO4 | B、加BaCl2溶液后所得的白色沉淀是BaSO4 | C、白色固体中夹杂的少量黑色物质可能是CuO | D、白色固体中夹杂的少量黑色物质中含铜元素、氧元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com