
(10分)工业制硫酸生产流程如下图:

(1)在气体进入催化反应室前,需净化的原因是:________________________________。
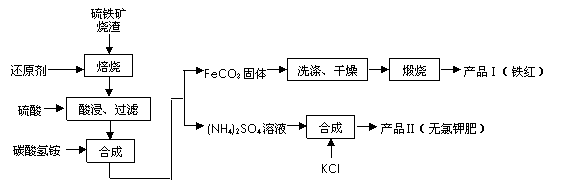
(2)在制气过程中,我国往往以黄铁矿为原料制SO2 ,其铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
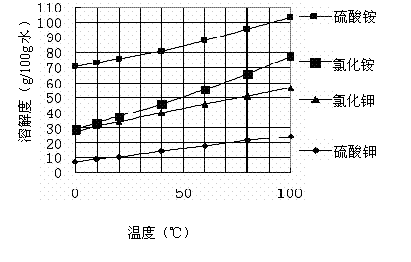
已知几种盐的溶解度随温度变化的曲线如下图所示:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
则:
①酸浸、过滤后滤液中的金属阳离子是________________。
②煅烧FeCO3生成产品Ⅰ的化学反应方程式为_______________________________ _。
③产品Ⅱ的化学式为_______________
④检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
(10分) 硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)V2O5是SO2与O2反应的催化剂,请写出该反应的方程式:
_____________________________________________________________________。
(2)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为_____________;生成SO3的化学反应速率为_________________。
(3)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
A.压缩体积,增大压强 B.降低温度
C.充入大量的氮气 D.仅增加SO2的浓度
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式
______________________________________________________。
查看答案和解析>>
科目:高中化学 来源:09~10年西南师大附中高一下期期末考试化学卷 题型:填空题
(10分) 硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)V2O5是SO2与O2反应的催化剂,请写出该反应的方程式:
_____________________________________________________________________。
(2)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为_____________;生成SO3的化学反应速率为_________________。
(3)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
| A.压缩体积,增大压强 | B.降低温度 |
| C.充入大量的氮气 | D.仅增加SO2的浓度 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省宜宾市高三第一次诊断性测试化学试卷(解析版) 题型:填空题
(12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)
 2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
A.υ(O2)正=2υ(SO2)逆
B.容器中气体的总质量不随时间而变化
C.容器中气体的颜色不随时间而变化
D.容器中气体的压强不随时间而变化
(2)下列关于反应2SO2(g)+O2(g)
 2SO3(g)
ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g)
ΔH<0。下列图像中不正确的是______ (填字母序号)。

(3)某温度下SO2(g)+ 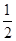 O2(g)
O2(g)
 SO3(g)
ΔH=-98KJ/mol
SO3(g)
ΔH=-98KJ/mol
①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的 BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________
查看答案和解析>>
科目:高中化学 来源:09-10年西南师大附中高一下期期末考试化学卷 题型:填空题
(10分) 硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)V2O5是SO2与O2反应的催化剂,请写出该反应的方程式:
_____________________________________________________________________。
(2)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为_____________;生成SO3的化学反应速率为_________________。
(3)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
A.压缩体积,增大压强 B.降低温度
C.充入大量的氮气 D.仅增加SO2的浓度
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式
______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com