
����Ŀ���±���ʵ����Ԫ�����ڱ��IJ��ֱ߽磬�����ϱ߽粢δ��ʵ�߱����
������Ϣ�ش��������⡣
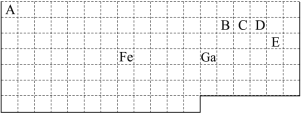
��1�����ڱ��л�̬Gaԭ�ӵ����������Ų�ʽΪ ��
��2��FeԪ��λ�����ڱ��� ����Fe��CO���γ������Fe(CO)5����Fe(CO)5�����Ļ��ϼ�Ϊ ����֪��ԭ����Ŀ�͵�������(��۵�������)��ͬ������Ϊ�ȵ����壬�ȵ�����������ƵĽṹ��������CO���ӻ�Ϊ�ȵ�����ķ��Ӻ����ӷֱ�Ϊ �� (�ѧʽ)��
��3����CH4��CO2��CH3OH�У�̼ԭ�Ӳ�ȡsp3�ӻ��ķ����� ��
��4������VSEPR����Ԥ��ED4-���ӵĿռ乹��Ϊ ��B��C��D��Eԭ��������γɵķ����У�����ԭ�Ӷ����������8�����ȶ��ṹ�ķ��ӵĵ���ʽΪ (д2��)��
���𰸡���1��4s24p1��2��d 0 N2CN����3��CH4��CH3OH ��4���������� CO2��NCl3��CCl4(��д2�ּ���)
�������������������1��31��Ԫ��Gaԭ�ӻ�̬�����������Ų�ʽΪ4s24p1����2��26��Ԫ��FeԪ�������ڱ���λ�ڵ������ڵ����壬λ�����ڱ���d����Fe��CO���γ������Fe(CO)5����Fe(CO)5�����Ļ��ϼ�Ϊ0�ۡ���CO���ӻ�Ϊ�ȵ�����ķ�����N2������ΪCN������3����CH4��CO2��CH3OH�У�̼ԭ�Ӳ�ȡsp3�ӻ��ķ�����CH4��CH3OH��CO2�е�Cԭ�ӵ��ӻ���ʽΪsp�ӻ�����4�����ݱ����и���Ԫ�ص����λ�ÿ��Կ�����A��H��B��C��C��N��D��O��E��Cl������VSEPR����Ԥ��ClO4-���ӵĿռ乹��Ϊ���������͡���C��N��O��Clԭ��������γɵķ����У�����ԭ�Ӷ����������8�����ȶ��ṹ�ķ�����CO2��NCl3��CCl4�������ʽΪ![]() ��
�� ��
�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ͬ��ͬѹ�£�ͬ�����S18O2���������壨H2S�������ʵ���֮��Ϊ_____������֮��Ϊ_____��ͬ��ͬѹ�£���������S18O2��H2S���ܶ�֮��Ϊ_____��
��2������0.2mol/L��BaCl2��Һ����2L����Һ�к���_____molBa2+��3L����Һ�У�Cl�������ʵ���Ũ����_____mol/L����ԭ��Һȡ��10mL��ϡ�͵�250mL����������Һ�����ʵ���Ũ����_____mol/L�������Һ����200mL������Һ��ǡ�ý�����Һ�еı�������ȫ���������������Һ�����ʵ���Ũ����_____mol/L�����������˺�ϴ�Ӹ��ﲢ���������ù����������_____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1871���Ž��з�����Ԥ�������Ԫ���࣬1886��¹���ѧ���¿��շ��ֺͷ�������Ԫ�أ��������������������Ϊ��Ge����������Ҫ�İ뵼����ϣ����л������������ư�֢�������Ŷ��صĹ�Ч����ͼΪ��ҵ��������п��(��Ҫ�ɷ�GeO2��ZnS)���Ʊ��ߴ���������̡�
��֪��1��������һ���л��������������ļ�������γɳ�����2��GeCl4��ˮ�⣬��Ũ�������ܽ�ȵ͡�

(1)������������������Ч�ʵĴ�ʩ___________(д����)��
(2)����������A������___________��
(3)�������е�������___________(����������)�м��ȡ�
(4)������������ϡ���ᣬԭ�������___________��
(5)д���������Ļ�ѧ����ʽ___________��д���������Ļ�ѧ����ʽ___________��
(6)��д��һ��֤����������Ӧ��ȫ�IJ�������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ���Ҳ��������Է�Һ�к���Fe3+��Cu2+��Ba2+��Cl����ʵ����������з����Է�Һ[���Ϊ1 L��c(H+)=0.10 mol/L]���д������Ի��ս������ⶨ������
�ش��������⣺
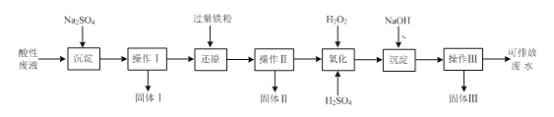
��1��ʵ���в���I��II��III�ķ�����ͬ�������õIJ����������ձ���©����____��
��2������ԭ������ʱ���������ӷ���ʽΪ____��ֻ��д����������һ�������������������Ŀ����____��
��3������III��õ����ŷŷ�ˮ�к��е�������Ҫ��____���ѧʽ����
��4����������ʵ��ⶨ��
�ٽ�����II�õ��Ĺ���II��������ϡ���ᣬ��ַ�Ӧ���õ��Ĺ�������Ϊ9.6 g��
�ڽ�����III�õ��Ĺ���III���г�����գ��õ��ĺ���ɫ��������Ϊ40.0 g��
ԭ��Һ��Fe3+�����ʵ���Ũ���Ƕ���___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС����̽�������Ļ�ѧ���ʣ������ͼ��ʾ��ʵ��װ�á�

��֪����װ�����������ã�ͭ�۷�������������(��ֹӲ�ʲ�����ը��)��
��ش��������⣺
��1��Ϊ��ֹͭ������е�������Ӧ���ڼ���֮ǰӦ�ý��еIJ���Ϊ____��
��2�����۲쵽AgNO3��Һ�г��ְ�ɫ����ʱ����ȼ�ƾ��Ƽ��ȣ�д��AgNO3��Һ�з�����Ӧ�Ļ�ѧ����ʽ��____��
��3��Ӳ�ʲ������еķ�Ӧ����Ϊ____����Ӧ�Ļ�ѧ����ʽΪ____��
��4��װ���п��Թܵ�������____��
��5��ʵ���У��۲쵽��ɫʯ����Һ��ɫ�ı仯Ϊ____��
��6���ձ�������������Һ��������___��������Ӧ�Ļ�ѧ����ʽΪ_____��
��7��ʢˮ���Թ��У���Һ������ɫΪ___��˵������____(������������������)����ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����ø������̻�(��Fe��Mn��SiO2��������Al2O3��CaO��MgO)�Ʊ�MnCO3�Ĺ����������£�
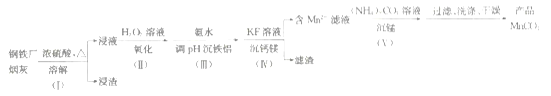
��֪25��ʱ��������������ܶȻ�������
������ | CaF2 | MgF2 | MnCO3 | Mn(OH)2 |
Ksp | 4.0��10-11 | 6.4��10-9 | 2.2��10-11 | 1.9��10-13 |
�ش��������⣺
(1)����(��)��������Ҫ�ɷ���______________(�ѧʽ)��
(2)����(��)��H2O2��Һʱ��Ӧ�����ӷ���ʽΪ________________��
�Ӱ�ˮ����pH������ʱ������(��)Ӧ���ڵ�pH���˷�ΧΪ____________��(���ֽ������ӿ�ʼ�����������ȫ��pH��Χ����)
�������� | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
����pH��Χ | 7.6��9.6 | 2.7~3.7 | 3.4~5.2 | 8.3~9.3 | 9.6��11.1 |
(3)����(��)��KF��Һ����þʱ��Ҫʹc(Ca2+)��c(Mg2+)��С��1��10-6mol��L-1����Ӧ���Ʒ�ӦҺ��c(F-)>___________mol��L-1����ӦMgF2(s)+Ca2+![]() CaF2(s)+Mg2+��ƽ�ⳣ��K=___________��
CaF2(s)+Mg2+��ƽ�ⳣ��K=___________��
(4)���������ʱ����60�水Ͷ�ϱ�n[(NH4)2CO3]/n(Mn2+)=2����Һ��pH��MnCO3���ʵ�Ӱ����ͼ��ʾ��pH=7����Ͷ�ϱ�n[(NH4)2CO3]/n(Mn2+)=2����Ӧ�¶ȶ�MnCO3���ʵ�Ӱ����ͼ��ʾ��
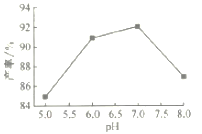
����ͼ�У���pH<7.0ʱ��pHԽС����____________(����Խ��������Խ��������pH>7.0ʱ��pHԽ�����Խ���Ҵ���Ҳ���ͣ���ԭ����___________________��
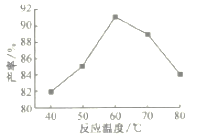
����ͼ�У��¶ȸ���60��ʱ���¶�Խ�߲���Խ���Ҵ���ҲԽ�ͣ���Ҫԭ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н���ʵ������ķ�Ӧ����ʽ��ȷ���ǣ� ��
A.�п��Ľ���Na��¶�ڿ����У����������䰵��2Na��O2=Na2O2
B.��Na�����ˮ�У��������壺2Na��2H2O=2NaOH��H2��
C.Na2O2�ڳ�ʪ�Ŀ����з���һ��ʱ�䣬��ɰ�ɫճ���2Na2O2��2CO2=2Na2CO3��O2
D.����������ȼ�ղ����غ�ɫ���̣�Fe��Cl2=FeCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�صĻ�̬ԭ�ӵĺ��������3������״̬��5�ֿռ�״̬��X�����е�һ��������С��Ԫ�أ�Ԫ��Y��M������˶�״̬��X�ļ۵����˶�״̬��ͬ��Ԫ��Zλ�ڵ������ڣ����̬ԭ�ӵ�2��������M����ȫ���������ӡ�
(1)X��̬ԭ�ӵĵ����Ų�ʽΪ___________��
(2)X���⻯��(H2X)���Ҵ��е��ܽ�ȴ���H2Y����ԭ����___________��
(3)��Y���⻯��(H2Y�����У�Yԭ�ӹ�����ӻ�������___________��
(4)Y��X���γ�YX32����
��YX32�������幹��Ϊ___________(����������)��
��д��һ����YX32����Ϊ�ȵ�����ķ��ӵĻ�ѧʽ___________��
(5)Z���Ȼ����백ˮ��Ӧ���γ������[Z(NH3)4(H2O)2]Cl2������������ʱ������ʧȥ�������е�������___________(д��ѧʽ)��
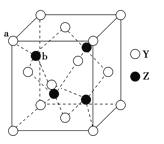
(6)Y��Z���γɻ����ᄃ��ľ�����ͼ��ʾ���û�����Ļ�ѧʽΪ___________���侧���߳�Ϊ540.0pm���ܶ�Ϊ___________g��cm��3(��ʽ������)��aλ��Y��bλ��Z֮��ľ���Ϊ___________pm(��ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ���������ֻ�����Ӧ���ͣ�������������ԭ��Ӧ����( )
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl��+NaNO3
C.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D.2KMnO4![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com