
设NA代表阿伏加德罗常数的值。下列说法错误的是
A.30g甲醛(CH2O)与30g葡萄糖均含有NA个碳原子
B.0.1molCl2与过量稀NaOH 溶液作用转移电子数0.2NA
C.常温下,1L pH=1的硫酸由水电离出的H+ 约为1×10-13NA
D.石墨电极电解CuSO4 溶液,阴极上有4mol电子转移,阳极上有NA个O2
B
【解析】
试题分析:A.甲醛和葡萄糖的最简式相同,均是CH2O,所以30g甲醛(CH2O)与30g葡萄糖中碳原子的物质的量均是1mol,所以均含有NA个碳原子,A正确;B.氯气与氢氧化钠溶液反应时氯气既是氧化剂,也是还原剂,则0.1molCl2与过量稀NaOH 溶液作用转移电子数0.1NA,B错误;C.常温下,1L pH=1的硫酸溶液中氢氧根浓度是1×10-13mol/L,则由水电离出的氢离子浓度也是1×10-13mol/L,所以由水电离出的H+约为1×10-13NA,C正确;D.石墨电极电解CuSO4 溶液,阴极上铜离子放电析出铜,阳极时氢氧根放电产生氧气,所以有4mol电子转移时,阳极上有1mol氧气产生,即产生NA个O2,D正确,答案选B。
考点:考查阿伏加德罗常数的计算


科目:高中化学 来源:2014-2015学年四川省资阳市高三第二次诊断性考试理综化学试卷(解析版) 题型:选择题
下表中关于物质分类的正确组合是
类别 组合 | 酸性 氧化物 | 碱性 氧化物 | 电解质 | 强电解质 | 高分子 物质 |
A | CO2 | CuO | 氨气 | NH3·H2O | 葡萄糖 |
B | SO3 | Na2O | 稀硫酸 | NaOH | 果糖 |
C | SO2 | CaO | 冰醋酸 | KOH | 纤维素 |
D | N2O5 | Na2O2 | α-丙氨酸 | Cu(OH)2 | 聚乙烯 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列物质的分子正负电荷重心不相重合的是
A.C2H2 B.CO2 C.NH3 D.BF3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省安康市高三上学期第二次教学质量调研化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.H2、D2和T2互称为同位素,它们的化学性质几乎—样
B.二氧化碳、盐酸、氨水分别属于非电解质、强电解质、弱电解质
C.胶体和其它分散系的本质区别是丁达尔效应
D.硅是一种良好的半导体材料,可以制成计算机芯片和硅太阳能电池
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省晋中市高三1月考前适应性训练理综化学试卷(解析版) 题型:选择题
下列实验现象与对应结论正确的是
选项 | 操作 | 现象 | 结论 |
A | 将浓硫酸滴到蔗糖表面 | 固体变黑 | 浓硫酸有脱水性和强氧化性 |
B | 常温下将Al片放入浓硫酸中 | 无明显变化 | Al与浓硫酸不反应 |
C | 将水蒸汽通过灼热的铁粉 | 粉末变红 | 铁与水蒸气在高温下发生反应 |
D | 将某气体通入品红溶液中 | 溶液褪色 | 该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:填空题
(19分)
(1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知: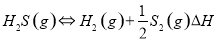 在恒容密闭容器中,控制不同温度进行H2S分解实验。
在恒容密闭容器中,控制不同温度进行H2S分解实验。
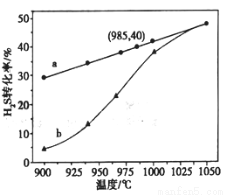
以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。 _____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
_____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
②电化学法
该法制氢过程的示意图如图。反应池中反应的离子方程式是___________________;
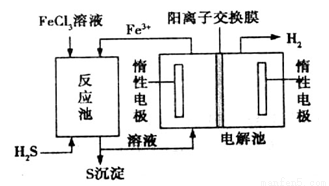
反应后的溶液进入电解池,电解总反应的离子方程式为________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式_______________________________________________。
②电池总反应的化学方程式_________________________________________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KmnO4溶液进行滴定,实验所得数据如下表所示;
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液__________________________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.萃取操作时,选择有机萃取剂,则溶质在萃取剂的溶解度必须比水大
B.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.蒸馏操作时,应使温度计水银球插入混合溶液的液面下
D.配制一定物质的量浓度的溶液时,洗涤烧杯和玻璃棒的溶液必须转入容量瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
5.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O  KIO3+3H2↑。下列有关说法不正确的是(相对原子质量:K:39,I:127,O:16)
KIO3+3H2↑。下列有关说法不正确的是(相对原子质量:K:39,I:127,O:16)
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I――6e-+3H2O=IO3-+6H+
C.当电解过程中转移3mole-时,理论上可制得KIO3 107g
D.电解前后溶液的pH几乎不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都郫县高三第二次阶诊断性考试理综化学试卷(解析版) 题型:填空题
(14分)以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下:

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
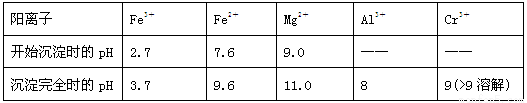
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:
__________________________________、____________________________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?请用必要的文字和离子方程式解释:_______________________________________________________。
(4)流程图中“□”内的操作是___________________、______________________、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com