
【题目】在固态金属氧化物电解池中,高温电解H2OCO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A.X是电源的负极
B.阴、阳两极生成的气体的物质的量之比是1∶1
C.总反应可表示为H2O+CO2![]() H2+CO+O2
H2+CO+O2
D.阴极的电极反应式是H2O+2e-=H2+O2-、CO2+2e-=CO+O2-
【答案】B
【解析】
高温共电解H2O-CO2混合气体制备H2和CO,可以看作是电解H2O气体制备H2、O2(2H2O![]() 2H2↑+O2↑)和电解CO2气体制备CO、O2(2CO2
2H2↑+O2↑)和电解CO2气体制备CO、O2(2CO2![]() 2CO+O2),电极反应分别为:阳极(失电子,发生氧化反应):2H2O-4eˉ=O2+4H+ ; CO2-4eˉ=O2+C4+ 。
2CO+O2),电极反应分别为:阳极(失电子,发生氧化反应):2H2O-4eˉ=O2+4H+ ; CO2-4eˉ=O2+C4+ 。
阴极(得电子,发生还原反应):2H2O+4eˉ=2H2+O2ˉ ; 2CO2+2eˉ=2CO+2O2ˉ。
所以,总反应可表示为:H2O+CO2![]() H2+CO+O2 ;阴、阳两极生成的气体的物质的量之比是2︰1。依据电解池原理,阴极与电源的负极相连,据图中所示,与X相连的电极上发生H2O→H2,CO2→CO的转化,均为得电子,发生还原反应,故与X相连的电极为电解池的阴极,则X是电源的负极。
H2+CO+O2 ;阴、阳两极生成的气体的物质的量之比是2︰1。依据电解池原理,阴极与电源的负极相连,据图中所示,与X相连的电极上发生H2O→H2,CO2→CO的转化,均为得电子,发生还原反应,故与X相连的电极为电解池的阴极,则X是电源的负极。
综上分析可知,选项B不正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】氢气是热量高、无污染的燃料,天然气储量丰富是理想的制氢原料,研究甲烷制氢具有重要的理论和现实意义。
(1)甲烷水蒸气重整制氢:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H1=+216kJmol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
CO(g)+3H2(g)△H1=+216kJmol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
(2)①将甲烷水蒸气重整和甲烷氧化重整两种方法结合,理论上按照空气、甲烷、水蒸气约15:7:1体积比进料(空气中氧气体积分数约为0.2),可以实现反应器中能量自给(不需要补充热量)。
甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2=____kJmol-1
②实际生产中,空气、甲烷、水蒸气按照约1:1:2体积比进料,增加水蒸气的作用是____,还能发生____(用化学方程式表示)反应,从而获得更多的氢气。
(3)甲烷水蒸气重整过程中,温度1000K,原料气以57.6Kgh-1通入容积为1L镍基催化反应器中,2-5s甲烷质量分数由7.32%变为5.32%,用甲烷表示2-5s的反应速率为____molmin-1 ,随着反应的进行反应速率会急速下降,可能的原因是甲烷等高温不稳定,造成____。有人提出将甲烷水蒸气重整和甲烷氧化重整两种方法结合则能解决这个问题,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和甲烷等原料在工业生产中发挥着重要的作用。
Ⅰ.我国科学家以MoS2 为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图所示。
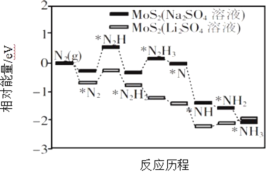
(1)将Na2SO4 溶液换成Li2SO4 溶液后,反应速率明显加快的主要原因是加快了下列____________转化的反应速率(填标号)。
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
Ⅱ. 甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(2)已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH1=akJ·mol—1,
2CO(g)+O2(g)= 2CO2(g) ΔH2=b kJ·mol—1,
2H2(g) +O2(g)=2 H2O (l) ΔH3=c kJ·mol—1
CO(g)+ H2O(g)= CO2(g)+ H2 (g) ΔH4=d kJ·mol—1
则甲烷水蒸气重整反应的ΔH=____________kJ·mol—1(用字母a、b、c、d表示)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2物质的量分数与水碳比、平衡温度的关系如图所示:
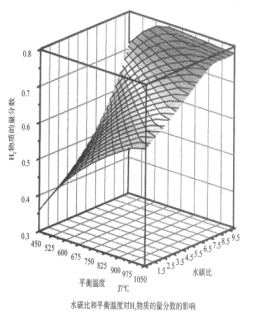
①结合如图回答:当平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系是________,其原因是_____________。
②若密闭容器中仅发生CH4(g)+H2O(g)![]() CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
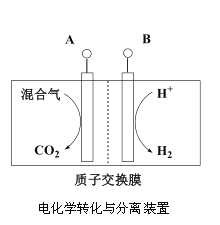
Ⅲ.利用天然气合成氨,并生产尿素的流程如下:
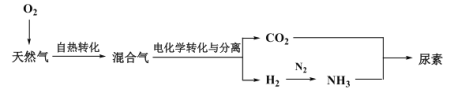
(3)“电化学转化与分离”装置如图,混合气中CO转化成CO2的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:已知(a、b、c均大于零):H2(g)+I2(g) ![]() 2HI(g) ΔH=-a kJ·mol-1。
2HI(g) ΔH=-a kJ·mol-1。
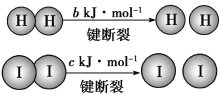
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种二次锂离子电池工作时反应为:LixCn + Li(1-x)CoO2 == LiCoO2 + nC。电池如图所示。下列说法不正确的是

A.放电时,碳材料极失去电子,发生氧化反应,电子经外电路,Li+经内电路同时移向正极
B.放电时正极反应为: Li(1-x)CoO2 + xLi+ + xe- = LiCoO2
C.充电时, Li+从负极脱出,又嵌入正极
D.锂离子二次电池正负极之间充放电时发生传输 Li+的反应,少有副反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】途经张家界的黔张常铁路是我国“八纵八横”高速铁路网之一,于2019年12月26日开通,高铁的铝合金车体的优势是:制造工艺简单,节省加工费用;减重效果好;有良好的运行品质;耐腐蚀,可降低维修费。工业上制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的Al2O3,然后电解Al2O3得到铝。下图是从铝土矿中提纯Al2O3的简单示意图。其中涉及到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。
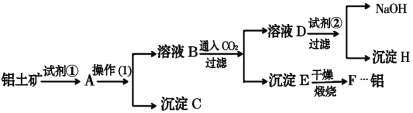
(1)图示中实验操作(1)是________;加入的试剂②是__________(填化学式)。
(2)试写出下列物质(或溶液中的溶质)的化学式:B__________________;D__________________;H________________。
(3)写出化学方程式:
①铝土矿→A:_____________________________________。
②E→F:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向碘水中滴加Na2SO3溶液时发生反应:Na2SO3+I2+H2O=2HI+Na2SO4,下列说法不正确的是
A.Na2 SO3为还原剂B.I2发生氧化反应
C.还原性:Na2SO3 > HID.每生成1molNa2SO4,理论上转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将9.5gMgCl2溶于水配成1L溶液,所得溶液的物质的量浓度为___mol/L,500mL该溶液中所含Cl-的物质的量为___mol。
(2)含有2NA个氢原子的CH4的质量为___g。
(3)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用下列序号填空:能导电的是___(填选项);属于电解质的是___(填选项)。
A.①③ B.②④ C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com