
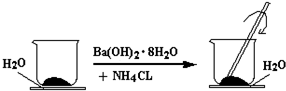
分析 (1)①实验中玻璃棒的作用是搅拌使反应物充分接触并反应;
②氯化铵铵盐和强碱氢氧化钡的反应生成氨气、水、以及氯化钡,反应为复分解反应;
③玻璃片上结冰而与小烧杯粘在一起,说明氢氧化钡和氯化铵的反应是吸热反应;
(2)①水分子中存在共价键,水的分解为吸热反应,在催化剂的条件下生成氢气和氧气,燃料电池是将化学能转变为电能的装置;
②原电池中,具有还原性的物质的做负极,电子从负极经外电路流向正极;
③原电池负极失去电子,化合价升高,发生氧化反应,根据总反应式2Zn+O2+4H+═2Zn2++2H2O进行分析;
(3)化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,化学反应中的反应热△H=反应物总键能-生成物总键能,注意氢气在氧气中燃烧,反应热△H<0,每摩尔H2O中含有2molH-O键,据此计算.
解答 解:(1)①实验中玻璃棒的作用是搅拌使反应物充分接触并反应,
故答案为:搅拌,使混合物充分接触;
②氯化铵属于铵盐,能和强碱氢氧化钡发生复分解反应,生成氨气、水、以及氯化钡,化学方程式为Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,
故答案为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;复分解;
③玻璃片上结冰而与小烧杯粘在一起,说明氢氧化钡和氯化铵的反应是吸热反应,即反应物的总能量小于生成物的总能量,
故答案为:小于;
(2)①水难以分解,水分子中存在共价键,在二氧化钛(TiO2)表面作用使海水分解得到氢气,并用激光提供能量,则说明二氧化钛起到催化剂的作用,该反应吸热,燃料电池是将化学能转变为电能的装置,故答案为:化学;电;共价;吸热;
②氢气具有还原性,在负极上被氧化而失去电子,电子从负极经外电路流向正极,故答案为:负;流出;
③原电池负极失去电子,化合价升高,发生氧化反应,根据总反应式2Zn+O2+4H+═2Zn2++2H2O,得到负极反应为:Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(3)破坏1molH-H消耗的能量为Q1kJ,则H-H键能为Q1kJ/mol,破坏1molO═O键消耗的能量为Q2kJ,则O═O键键能为Q2kJ/mol,
形成1mol水中的化学键释放的能量为Q3kJ,每摩尔H2O中含有2molH-O键,1molH-O键释放的能量为$\frac{1}{2}$Q3kJ,则H-O键能为$\frac{1}{2}$Q3kJ/mol,
对于反应2H2(g)+O2(g)═2H2O(l)反应热△H=反应物的总键能-生成物的总键能,
所以反应热△H=2Q1kJ/mol+Q2kJ/mol-4×$\frac{1}{2}$Q3kJ/mol=(2Q1+Q2-2Q3)kJ/mol,
由于氢气在氧气中燃烧,反应热△H<0,即(2Q1+Q2-2Q3)<0,所以2Q1+Q2<2Q3,
故答案为:D.
点评 本题考查吸热反应的探究,本题注意把握氯化铵和氢氧化钡反应的原理,注意从反应物与生成物总能量的关系分析;
考查化学电源新型电池以及原电池的工作原理,本题注意基础知识的积累;
考查反应热的计算,题目难度不大,注意从物质能量、键能角度理解反应热,明确反应热的焓变△H=反应物总键能-生成物总键能及焓变的正负与吸收、放热热量的关系.


科目:高中化学 来源: 题型:解答题
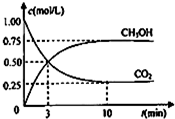 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料, 负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空
负极电极反应为:3H2-6e-=6H+(氧化反应);若不能,请说明原因:空查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该烃分子中有碳碳双健 | |
| B. | 该烃分子中有碳碳三健 | |
| C. | 该烃的分子结构可能有两种 | |
| D. | 该烃分子中所有原子可在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油和天然气都属于碳素燃料 | |
| B. | 发展太阳能经济有助于减缓温室效应 | |
| C. | 太阳能电池可将太阳能转化为电能 | |
| D. | 太阳能发电过程中具有重要作用的半导体材料是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 | |
| C. | O2和O3互为同位素 | |
| D. | O2和O3的相互转化不是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过盛水的洗气瓶 | B. | 通过装有过量溴水的洗气瓶 | ||
| C. | 和过量H2混合 | D. | 通过酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥ | B. | ⑥⑦ | C. | ⑤⑥⑦ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有Al(OH)3、Fe(OH)3沉淀析出 | |
| B. | 所得混合液中:$\frac{c(A{l}^{3+})}{c(F{e}^{3+})}$=3.25×104 | |
| C. | 所得混合液中相关微粒的浓度大小:c(Cu2+)=c(Al3+)>c(Fe3+)>c(H+) | |
| D. | 若向原溶液中逐滴加入NaOH溶液,最后析出的是Cu(OH)2沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com