
(12分)短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。已知B元素形成的化合物种类最多,D元素原子最外层电子数是次外层电子数的3倍,元素E的原子半径在同周期中最大,F元素原子最外层电子数等于其电子层数。
(1)C元素在元素周期表中的位置是_____________________,B的单质与C的最高价氧化物对应水化物的浓溶液发生反应的化学方程式是_____________________________________
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是________ _______
(3)写出E2D2与A2D反应的离子方程式
_______________________________________________________________________。
(4)实验室配制100mL0.2mol·L—1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、小烧杯外还有_________________________;如果定容时仰视刻度线,则所配制溶液浓度_________0.2mol·L—1(埴“>”、“<”或“=”)。将F的单质溶于上述配制的溶液中所发生反应的离子方程式是________________ _________
(1)第二周期第VA族(1分)
C+4HNO3(浓)=CO2↑+4NO2↑+2H2O(2分)
(2)离子键、共价键(2分)
2Na2O2+2H2O=4Na++4OH-+O2↑(2分,写化学方程式不给分)
(3)玻璃棒、100mL容量瓶(2分)
<(1分,填“小于”不给分)
2Al+2OH—+6H2O=2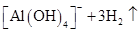 (2分)
(2分)
【解析】
试题分析:B元素形成的化合物种类最多,则B是C,D元素原子最外层电子数是次外层电子数的3倍,则D是O,元素E的原子半径在同周期中最大,则E是Na;F元素原子最外层电子数等于其电子层数,则F为Al;短周期主族元素A、B、C、D、E、F的原子序数依次增大,则C为N;原子核外电子层数之和为13,则A是H。
(1)N元素在元素周期表中的位置是第二周期第VA族,C单质与N的最高价氧化物对应水化物的浓HNO3发生反应的化学方程式是C+4HNO3(浓)=CO2↑+4NO2↑+2H2O。
(2)由H、C、O、Na四种元素形成的化合物,可以是NaHCO3或CH3COONa等;所含的化学键类型有离子键、共价键。
(3)Na2O2与H2O反应放出氧气,生成氢氧化钠,2Na2O2+2H2O=4Na++4OH-+O2↑。
(4)配制100mL0.2mol·L—1 NaOH溶液,根据实验步骤,需要用到的玻璃仪器烧杯、小烧杯、玻璃棒、100mL容量瓶、胶头滴管;如果定容时仰视刻度线,则所配制溶液体积偏大,浓度偏小。将铝的单质溶于氢氧化钠中所发生反应的离子方程式是2Al+2OH—+6H2O=2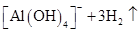
考点:考查元素的推断、方程式的书写及溶液的配制。
点评:利用原子结构作为突破口推断元素要注意题干中的隐含条件。属于简单题。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物. NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+ 2NO2
2NO2 2NO2
2NO2| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:A<D<C<B | B、B、C、D分别与A形成的化合物一定含有相同的化学键 | C、最高价氧化物对应水化物的酸性:D<C | D、常温下,单质B能大量溶于浓硝酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原于半径A<B<C | B、A的气态氢化物稳定性大于C的气态氢化物稳定性 | C、A、C两元素最高价氧化物均可与水化合得到对应的酸 | D、高温时,A单质可以从C的氧化物中置换得到C单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径由小到大的顺序:r(C)<r(D)<r(E) | B、元素D、E分别与A形成的化合物的热稳定性:E>D | C、元素D的最高价氧化物对应水化物的酸性比E的强 | D、元素B分别与A、C形成的化合物中化学键的类型完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com