
 (1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1
(1)甲醇(CH3OH)是一种重要的化工原料.已知 CH3OH(1)+O2(g)=CO(g)+2H2O(g);△H=-443.64kJ•mol-1 2B+C.
2B+C.分析 (1)①1molCH3OH(1)完全燃烧生成二氧化碳和液态水为燃烧热,结合盖斯定律、物质的量与反应中热量变化成正比计算;
②由甲醇和氧气以强碱做电解质溶液构成的原电池中,甲醇在负极上失去电子,氧气在正极上得到电子;
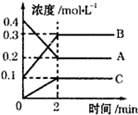
(2)①由图可知,A的物质的量浓度减少,B、C的物质的量浓度增加,则A为反应物、B、C为生成物,结合化学计量数之比等于浓度变化量之比计算;
②结合v=$\frac{△c}{△t}$计算;
③结合反应速率之比等于化学计量数之比计算A的反应速率,然后比较.
解答 解:①由a.CH3OH(1)+O2(g)=CO(g)+2H2O(g)△H=-443.64kJ•mol-1
b.2CO (g)+O2(g)=2CO2(g)△H=-566.00kJ•mol-1
c.H2O(1)=H2O (g)△H=+44.00kJ•mol-1
及1molCH3OH(1)完全燃烧生成二氧化碳和液态水为燃烧热可知,
a+b×$\frac{1}{2}$-c得到燃烧热的热化学方程式为CH3OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(1)△H=-814.64kJ•mol-1,
完全燃烧16g甲醇生成CO2和H2O(l)时,放出的热量为$\frac{16g}{32g/mol}$×814.64kJ=407.32kJ,
故答案为:CH3OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(1)△H=-814.64kJ•mol-1;407.32;
②由甲醇和氧气以强碱做电解质溶液构成的原电池中,甲醇在负极上失去电子,负极反应为CH3OH+8OH--6e-=CO32-+6H2O,氧气在正极上得到电子,
故答案为:正;负;
(2)①由图可知,A的物质的量浓度减少,B、C的物质的量浓度增加,则A为反应物、B、C为生成物,且△c(A):△c(B):△c(C)=2:2:1,2min时反应达到平衡,则反应方程式为2A 2B+C,
2B+C,
故答案为:2A 2B+C;
2B+C;
②2min内,用B表示的反应速率为$\frac{0.3mol/L-0.1mol/L}{2min}$=0.1mol/(L•min),故答案为:0.1mol/(L•min);
③反应速率之比等于化学计量数之比,则800℃时v(A)=v(B)=0.1mol/(L•min),可知在其他条件下,测得A的反应速率为0.05mol/(L•s)=3mol/(L•min),此时的反应与800℃时相比,比800℃时快,
故答案为:快.
点评 本题考查物质的量浓度随时间变化曲线、热化学反应及原电池,为高频考点,把握盖斯定律、燃烧热、原电池工作原理以及图中浓度变化、速率计算等为解答的关键,侧重分析与应用能力的考查,注意速率单位,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | 都错误 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH=H++CH3COO- | B. | HClO?H++ClO- | ||
| C. | H2SO4 $\frac{\underline{\;通电\;}}{\;}$=2H++SO42- | D. | Ca(OH)2?Ca2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 减压 | C. | 加压 | D. | 适当降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si与SiO2在常温下都可与NaOH溶液反应 | |
| B. | C与SiO2之间可以反应制备Si,同时得到CO | |
| C. | Si与SiO2都可以与氢氟酸反应 | |
| D. | Si→SiO2→H2SiO3可以通过一步反应实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品表面镀锌可以增强其抗腐蚀性 | |
| B. | 在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 有些合金比纯净的金属耐腐蚀 | |
| D. | 利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com