
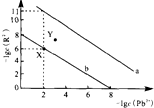
 25��ʱ��PbR��R2-ΪSO42-��CO32-���ij����ܽ�ƽ��������ͼ����֪Ksp��PbCO3����Ksp��PbSO4��������˵������ȷ���ǣ�������
25��ʱ��PbR��R2-ΪSO42-��CO32-���ij����ܽ�ƽ��������ͼ����֪Ksp��PbCO3����Ksp��PbSO4��������˵������ȷ���ǣ�������| A�� | ����a��ʾPbCO3 | |
| B�� | ��PbSO4��Na2CO3�ͽ�̿Ϊԭ�Ͽ��Ʊ�Pb | |
| C�� | ��PbSO4��PbCO3��������ʱ����Һ��$\frac{c��S{O}_{4}^{2-}��}{c��C{O}_{3}^{2-}��}$=105 | |
| D�� | ��X���Ӧ�ı�����Һ�м�������Pb��NO3��2����ת��ΪY���Ӧ����Һ |
���� A��Ksp��PbCO3����Ksp��PbSO4����Pb2+��ͬʱb������R2-��
B��PbSO4��Na2CO3�ͷ�ӦCO32-��aq��+PbSO4��s��?PbCO3��s��+SO42-��aq����PbCO3$\frac{\underline{\;\;��\;\;}}{\;}$PbO+CO2����2PbO+C$\frac{\underline{\;\;��\;\;}}{\;}$2Pb+CO2����
C����PbSO4��PbCO3��������ʱ����Һ��$\frac{c��S{O}_{4}^{2-}��}{c��C{O}_{3}^{2-}��}$���ڷ��Ӻͷ�ĸͬ����c��Pb2+���ɴ˷������
D����X���Ӧ�ı�����Һ�м�������Pb��NO3��2��c��Pb2+��Ũ������-lgc��Pb2+����С��
��� �⣺A��Ksp��PbCO3����Ksp��PbSO4����Pb2+��ͬʱb������R2-������b��PbSO4����A��ȷ��
B��PbSO4��Na2CO3��ӦCO32-��aq��+PbSO4��s��?PbCO3��s��+SO42-��aq����PbCO3$\frac{\underline{\;\;��\;\;}}{\;}$PbO+CO2����2PbO+C$\frac{\underline{\;\;��\;\;}}{\;}$2Pb+CO2�������Կ���PbSO4��Na2CO3�ͽ�̿Ϊԭ�Ͽ��Ʊ�Pb����B��ȷ��
C����PbSO4��PbCO3��������ʱ����Һ��$\frac{c��S{O}_{4}^{2-}��}{c��C{O}_{3}^{2-}��}$���ڷ��Ӻͷ�ĸͬ����c��Pb2+������$\frac{c��S{O}_{4}^{2-}��}{c��C{O}_{3}^{2-}��}$=$\frac{1{0}^{-2}��1{0}^{-6}}{1{0}^{-2}��1{0}^{-11}}$=105����C��ȷ��
D����X���Ӧ�ı�����Һ�м�������Pb��NO3��2��c��Pb2+��Ũ������-lgc��Pb2+����С�����Լ�������Pb��NO3��2��Ӧ��X����ߣ���D����
��ѡD��
���� ���⿼�����ܵ���ʵ�ת����Ϊ��Ƶ���㣬���ճ���ת����ʵ�ʡ�K��Ksp�Ĺ�ϵΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע���ܶȻ�С����ת��Ϊ��������Ŀ�ѶȲ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 | 0 | 2 | 4 | 6 | 8 | 10 |
| c��N2O4�� | 0.100 | c1 | 0.050 | c3 | a | b |
| c��NO2�� | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ��ѧʽ | pKsp | pH | |
| ��ʼ����ʱ | ������ȫʱ | ||
| Mg��OH��2 | / | 10.8 | 13.3 |
| Cu��OH��2 | / | 4.4 | / |
| Fe��OH��3 | / | 1.5 | / |
| Al��OH��3 | 33 | / | / |
| A�� | Mg��OH��2������pH=7��CH3COONH4��Һ | B�� | PKsp[Mg��OH��2]��PKsp[Cu��OH��2] | ||
| C�� | Fe��OH��3��PKsp=38.5 | D�� | Al3+����Һ�г�����ȫ��pH=5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
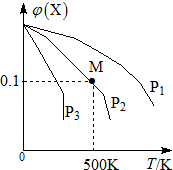 ij���淴ӦΪ2X��g��?3Y��g��+Z��g�������������X�����ʵ����������¶ȹ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ�������
ij���淴ӦΪ2X��g��?3Y��g��+Z��g�������������X�����ʵ����������¶ȹ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ�������| A�� | �ڸ�������M��Xƽ��ת����Ϊ$\frac{9}{11}$ | |
| B�� | ѹǿ��С��P3��P2��P1 | |
| C�� | ƽ�������Ч����ʹ������Է����������� | |
| D�� | �����¶ȣ��÷�Ӧƽ�ⳣ��K��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʵ�� ��� | ʱ�� Ũ�� �¡��� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800�� | 1.0 | c1 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800�� | 1.0 | c2 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800�� | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820�� | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
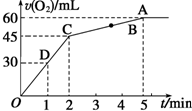 ����0.1mol MnO2��ĩ��50mL����������Һ����=1.1g•mL-1���У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ��
����0.1mol MnO2��ĩ��50mL����������Һ����=1.1g•mL-1���У��ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com