
(12分)硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g) 2SO3(g)达到平衡状态。
2SO3(g)达到平衡状态。
①上述反应平衡常数的表达式K=__________
②能判断该反应达到平衡状态的标志是__________。(填字母)
a. SO2和SO3浓度相等 b. SO2百分含量保持不变
c. 容器中气体的压强不变 d. SO3的生成速率与SO2的消耗速率相等。
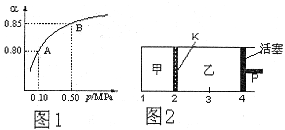
(2)某温度下,SO2的平衡转化率(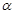 )与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
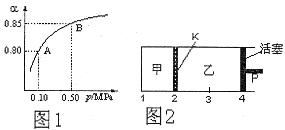
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲__________乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__________填:“增大”、“减小”、“不变”、“无法确定”)
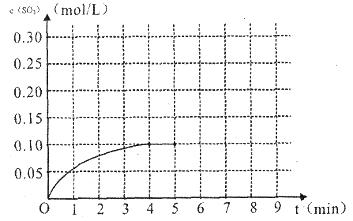
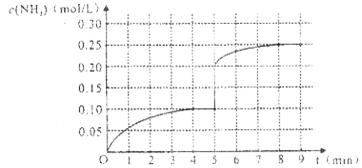
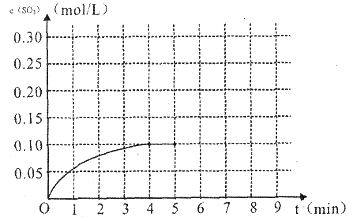
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
(1)①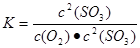 ②bc
②bc
(2)= (3)①小于 ②不变 (4)
【解析】(1)①平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此该反应的表达式为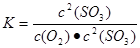 。
。
②在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以b正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,a不正确。反应时体积减小的,因此在反应反应过程中,压强是变化的,c正确。D中反应速率的方向是相同的,是恒成立的,d不正确,答案选bc。
(2)平衡常数只与温度有关系,所以AB两点的平衡常数相等。
(3)①乙的容积和甲相等时,相当于增大乙中压强,所以平衡向正反应方向移动,因此乙中SO2的体积分数大于甲中的。
②由于甲的体积不变,所以其浓度不变,平衡不移动,因此c(SO3)/c(SO2)不变。
在第5分钟将容器的体积缩小一半,则瞬间物质的浓度都是原来的2倍,但平衡向正反应方向移动,所以变化曲线是(见答案)。


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| c2(SO3) |
| c2(SO2)?c(O2) |
| 0.082 |
| 0.022×0.02 |
| 1 |
| 2 |
| c2(SO3) |
| c2(SO2)?c(O2) |
| 0.082 |
| 0.022×0.02 |
查看答案和解析>>
科目:高中化学 来源:上海市长宁区2011届高三上学期期末质量调研化学试题 题型:022
硫酸是重要的化工原料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g) 2SO3(g)达到平衡状态.
2SO3(g)达到平衡状态.
①从平衡角度分析采用过量O2的目的是________;判断该反应达到平衡状态的标志是________.(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
②该反应的平衡常数表达式为:K=________.
③已知:K(300℃)>K(450℃),该反应是________热反应.若反应温度升高,SO2的转化率________(填“增大”、“减小”或“不变”).
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示.平衡状态由A变到B时,平衡常数K(A)________K(B)(填“>”、“<”或“=”,下同).

(3)如图所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动.此时控制活塞P,使乙的容积为甲的2倍.

①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲________乙.
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲________乙.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省绍兴市鲁迅中学高二下学期期末考试化学试卷(带解析) 题型:问答题
(12分)硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g) 2SO3(g)达到平衡状态。
2SO3(g)达到平衡状态。
①上述反应平衡常数的表达式K=__________
②能判断该反应达到平衡状态的标志是__________。(填字母)
a. SO2和SO3浓度相等 b. SO2百分含量保持不变
c. 容器中气体的压强不变 d. SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率( )与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。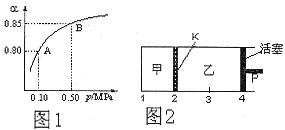
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲__________乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__________填:“增大”、“减小”、“不变”、“无法确定”)
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。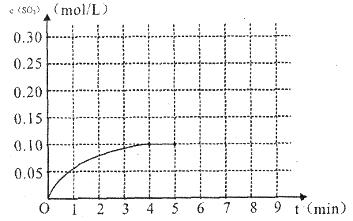
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态。
2SO3(g)达到平衡状态。
①上述反应平衡常数的表达式K=__________
②能判断该反应达到平衡状态的标志是__________。(填字母)
a. SO2和SO3浓度相等 b. SO2百分含量保持不变
C. 容器中气体的压强不变 d. SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率(![]() )与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲__________乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__________填:“增大”、“减小”、“不变”、“无法确定”)
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com