
已知H2(g)+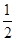 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
A.H2的燃烧热为241.8 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ
D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量
A
【解析】
试题分析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,题中水的状态是气态,不是稳定状态,水的稳定状态应该是液态,A不正确;B正确,由于气态水的能量高于液态水的能量,所以1mol H2完全燃烧生成液态水放出的热量大于241.8 kJ,C正确;反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以D正确,答案选A。
考点:考查燃烧热、反应热的有关判断和计算
点评:该题是中等难度的试题,也是高考中的常见考点之一。试题注重基础和能力的双向考查,有助于培养学生的逻辑推理能力。该题的关键是明确燃烧热以及反应热的概念,然后结合题意灵活运用即可。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:江苏省阜宁县中学2011-2012学年高二下学期期中调研考试化学试题 题型:013
|
已知H2(g)+ CO(g)+ 某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为 | |
| [ ] | |
A. |
2∶1 |
B. |
1∶2 |
C. |
1∶1 |
D. |
2∶3 |
查看答案和解析>>
科目:高中化学 来源:新课程同步学案专家伴读 化学选修4(化学反应原理) 鲁科版 鲁科版 题型:022
盖斯定律是指一个化学反应无论是一步完成还是分几步完成,________是一样的.即化学反应的焓变只与反应的________有关,而与反应的途径无关.
利用盖斯定律计算化学反应焓变的方法:若一个化学方程式可由另外几个化学方程式相加减而得到,则这些化学反应的焓变相应________,计算出想要计算的化学反应的焓变.
举例:
(1)已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1.写出C(s)燃烧生成CO的热化学方程式:___________.
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1.写出C(s)燃烧生成CO的热化学方程式:___________.
(2)已知:C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1.则反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH为
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1.则反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH为
A.262.6 kJ·mol-1
B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1
D.131.3 kJ·mol-1
(3)已知H2(g)+![]() O2(g)=H2O(l) ΔH=-285.83 kJ·mol-1,CO(g)+
O2(g)=H2O(l) ΔH=-285.83 kJ·mol-1,CO(g)+![]() O2(g)=CO2(g) ΔH=-282.9 kJ·mol-1.若氢气与一氧化碳的混合气体完全燃烧可生成5.4 g液态水,并放出114.03 kJ的热量,则混合气体中CO的物质的量为
O2(g)=CO2(g) ΔH=-282.9 kJ·mol-1.若氢气与一氧化碳的混合气体完全燃烧可生成5.4 g液态水,并放出114.03 kJ的热量,则混合气体中CO的物质的量为
A.0.22 mol B.0.15 mol C.0.1 mol D.0.05 mol
(4)0.3 mol的气态乙硼烷(B2H6)高能燃料在氧气中燃烧生成固态B2O3、液态水,并放出649.5 kJ热量,其热化学方程式为________________________.已知H2O(l)=H2O(g) ΔH=44 kJ·mol-1,则11.2 L标准状况下乙硼烷完全燃烧生成气态水时放出的热量为________kJ.
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第1期 总第157期 人教课标版(选修4) 题型:022
已知
H2(g)+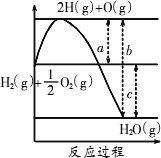
(1)a、b、c分别代表的意思是________、________、________.
(2)该反应是________(填“吸热”或“放热”)反应,ΔH________(填“<0”或“>0”).
查看答案和解析>>
科目:高中化学 来源:2012-2013年江苏南京学大教育专修学校高二3月月考化学试卷(带解析) 题型:单选题
已知H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1。下列说法中不正确的是 ( )
| A.H2的燃烧热为241.8 kJ·mol-1 |
| B.2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1 |
| C.1 mol H2完全燃烧生成液态水放出的热量大于241.8 kJ |
| D.断开1 mol H2O的化学键吸收的总能量大于断裂1 mol H2和0.5 mol O2的化学键所吸收的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com