
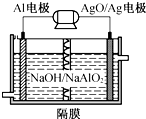
 铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )
铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )| A. | OH-向Al电极移动 | |
| B. | 正极的电极反应式:O2+2H2O+4e-═4OH- | |
| C. | Al电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 当电极上析出0.54 g Ag时,电路中转移的电子为0.005 mol |
分析 由原电池总反应可知,原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,AgO被还原,应为原电池的正极,电极反应式为AgO+2e-+H2O=Ag+2OH-,结合电极反应式进行判断.
解答 解:A.由原电池总反应可知,原电池工作时Al被氧化,应为电池的负极,在原电池中,电解质里的阴离子移向负极,即OH-向Al电极移动,故A正确;
B.AgO被还原,应为原电池的正极,电极反应式为AgO+2e-+H2O=Ag+2OH-,故B错误;
C.原电池工作时Al被氧化,应为电池的负极,电极反应为Al-3e-+4OH-=AlO2-+2H2O,故C正确;
D.Ag2O中Ag的化合价为+2价,正极上:Ag2O+2e-+H2O=2Ag+2OH-,当电极上析出0.54gAg即0.005mol时,电路中转移的电子为0.005mol,故D正确;
故选B.
点评 本题考查化学电源新型电池,题目难度中等,解答本题的关键是能正确书写电极方程式,做题时注意体会书写方法.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:X<Y<W | |
| B. | Y、Z两种元素的氧化物均具有两性 | |
| C. | X、W分别形成的氢化物中所含化学键种类相同 | |
| D. | Z、W形成化合物的电子式为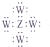 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
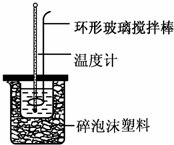 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金属Mg采用②堆积方式 | |
| B. | ①和③中原子的配位数分别为:8、12 | |
| C. | 对于采用②堆积方式的金属,实验测得W g该金属的体积为V cm3,则阿伏加德罗常数NA的表达式为$\frac{MV}{W•(\frac{4}{\sqrt{3}}r)^{3}}$ | |
| D. | ④中空间利用率的表达式为:$\frac{\frac{4}{3}π{r}^{3}×4}{(\frac{4}{\sqrt{2}}r)^{3}}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为: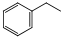 (g)$?_{高温(T)}^{Fe_{2}O_{3}}$
(g)$?_{高温(T)}^{Fe_{2}O_{3}}$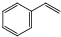 (g)+H2(g)△H=+120kJ•mol-1
(g)+H2(g)△H=+120kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:解答题
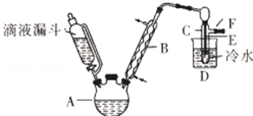 已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:
已知:R-OH+HX→R-X+H2O如图是实验室用乙醇与浓硫酸和溴化钠反应制备溴乙烷的装置,图中省去了加热装置.乙醇、溴乙烷、溴有关参数数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| B. | 减少机动车尾气的排放,可以降低雾霾的发生 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
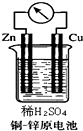 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com