
 室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )| A. | M点所示的溶液中c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| B. | Q点所示的溶液中c(NH4+)>c(Cl-)>c(H+)=c(OH-) | |
| C. | N点所示的溶液中c(NH4+)=c(Cl-) | |
| D. | M点和N点所示的溶液中水的电离程度相同 |
分析 由于Kw=(H+)×c(OH-)=10-14,则溶液的pH+pOH=14,实线为pH曲线,虚线为pOH曲线,作垂直体积坐标轴线与pH曲线、pOH曲线交点为相应溶液中pH、pOH.Q点的pH=pOH,则Q点溶液呈中性,据此进行解答.
解答 解:由于Kw=(H+)×c(OH-)=10-14,则溶液的pH+pOH=14,实线为pH曲线,虚线为pOH曲线,作垂直体积坐标轴线与pH曲线、pOH曲线交点为相应溶液中pH、pOH.Q点的pH=pOH,则Q点溶液呈中性,
A.M点溶液呈碱性,为NH4Cl、NH3•H2O混合溶液,溶液中c(NH4+)+c(NH3•H2O)>c(Cl-),故A错误;
B.Q点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(Cl-),正确的离子浓度大小为:c(NH4+)=c(Cl-)>c(H+)=c(OH-),故B错误;
C.N点溶液呈酸性,溶液中(H+)>c(OH-),结合电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),可知c(NH4+)<c(Cl-),故C错误;
D.M点溶液中氢离子源于水的电离,N点氢氧根离子源于水的电离,而M点氢离子浓度与N点氢氧根离子浓度相等,则M、N点所示溶液中水的电离程度相同,故D正确;
故选D.
点评 本题考查溶液酸碱性与溶液pH的关系,题目难度中等,关键是理解pH与pOH关系以及与二者与溶液酸碱性关系,离子浓度等量关系比较中常考虑电荷守恒、物料守恒、质子恒等式.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题

| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-2 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
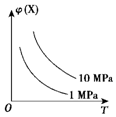
| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2HI(g)?H2(g)+I2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | C(s)+H2O(g)?H2(g)+CO(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 | |
| B. | 被氧化和被还原的元素分别为铜和氮 | |
| C. | 当产生0.2 mol气体时,转移电子为0.6 mol | |
| D. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
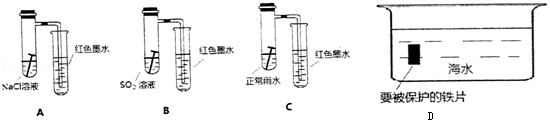
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
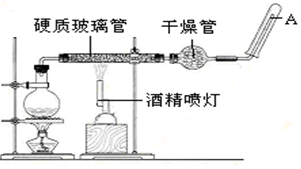
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时,电池负极周围溶液的c(OH-)为断增大 | |
| B. | 电池放电时,H2是负极 | |
| C. | 电池放时时,氢元素被氧化 | |
| D. | 电池放电时,镍元素被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
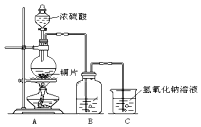 如图为足量铜与浓硫酸反应的装置.请回答:
如图为足量铜与浓硫酸反应的装置.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.24 mol/(L•min) | B. | 0.08 mol/(L•min) | C. | 0.06 mol/(L•min) | D. | 0.12 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com