

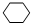
 +Br2→
+Br2→ .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$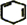 +2NaBr+2H2O.
+2NaBr+2H2O. 分析 由合成路线可知,反应①为光照条件下的取代反应,所以A为 ,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为
,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为 ,反应④为卤代烃的消去反应生成1,3-环己二烯,据此解答.
,反应④为卤代烃的消去反应生成1,3-环己二烯,据此解答.
解答 解:由合成路线可知,反应①为光照条件下的取代反应,所以A为 ,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为
,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为 ,反应④为卤代烃的消去反应生成1,3-环己二烯,
,反应④为卤代烃的消去反应生成1,3-环己二烯,
(1)A为 ,故答案为:
,故答案为: ;
;
(2)反应①为光照条件下的取代反应,反应③为环己烯的加成反应,故答案为:取代反应;加成反应;
(3)反应③的化学方程式是为 +Br2→
+Br2→ ,属于加成反应,故答案为:
,属于加成反应,故答案为: +Br2→
+Br2→ ;
;
(4)反应④的化学方程式是: +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O,属于消去反应,
+2NaBr+2H2O,属于消去反应,
故答案为: +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.
点评 本题考查有机物的合成、有机反应类型,注意根据反应条件与有机物结构解答,注意卤代烃的水解、消去反应的条件,题目难度不大.


科目:高中化学 来源: 题型:多选题
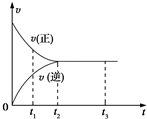 图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
图中是可逆反应X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,V(正)>V(逆) | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,各物质的浓度不再发生变化 | D. | t2~t3,反应不再发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为Ⅴ形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中S原子为sp6杂化 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 供电时的总反应为2H2+O2=2H2O | |
| B. | 负极电极反应为2H2+4OH--4e-=4H2O | |
| C. | 正极电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该燃料电池的能量转化率可达100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中A的金属性最强 | |
| B. | 原子半径A>B,离子半径A+>C2- | |
| C. | 同族元素中C的氢化物稳定性最高 | |
| D. | 同周期元素中B的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将铝片放入过量NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com