
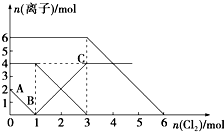
 已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为6 mol | |
| C. | 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
分析 首先根据氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,判断离子的反应先后顺序,然后根据图象判断参加反应的各离子的物质的量,
A.在氧化还原反应中还原剂的还原性强于还原产物的还原性,则根据方程式可知还原性:I->Fe2+>Br-;
B.氯气首先氧化碘离子,然后是亚铁离子,最后是溴离子,根据图象可知原混合溶液中碘离子是2mol、亚铁离子是4mol,溴离子是6mol,则FeBr2的物质的量为3 mol;
C.当通入2 mol Cl2时碘离子完全被氧化,亚铁离子一半被氧化,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-;
D.根据以上分析可知原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3.
解答 解:A.反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性:I->Fe2+>Br-,故A正确;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B错误;
C.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C正确;
D.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,则n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确.
故选B.
点评 本题考查氧化还原反应中氧化性和还原性强弱的知识,综合性较强,题目难度中等,解答本题时注意根据离子的还原性强弱结合图象判断反应的先后顺序和各离子的物质的量,为解答该题的关键,也是易错点.


科目:高中化学 来源: 题型:选择题
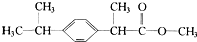
| A. | X难溶于水,易溶于有机溶剂 | B. | X能与液溴在一定条件下发生反应 | ||
| C. | X与酸、碱溶液均可以反应 | D. | X的水解产物能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L浓H2SO4中含有0.5gH2SO4 | B. | 0.5L含有49gH2SO4的溶液 | ||
| C. | 0.5gH2SO4溶于水配成2L溶液 | D. | 0.1L含24.5gH2SO4的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;D的结构简式CH2=CH2;
;D的结构简式CH2=CH2; ;反应类型加聚反应;
;反应类型加聚反应; +Br2 $\stackrel{催化剂}{→}$
+Br2 $\stackrel{催化剂}{→}$ +HBr;反应类型取代反应.
+HBr;反应类型取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都显碱性 | B. | 它们都有强还原性 | ||
| C. | 它们都能跟H2O、O2反应 | D. | Na只有还原性,Na+只有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于第四周期第IA族 | |
| B. | 能形成稳定的R2+离子 | |
| C. | 在化学反应中,首先失去3d上的电子 | |
| D. | 原子序数为28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
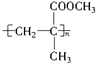 关于它的叙述不正确的是( )
关于它的叙述不正确的是( )| A. | 该有机玻璃的化学名称为聚甲基丙烯酸甲酯 | |
| B. | 该有机玻璃可用2-甲基丙烯酸和甲醇为原料,通过酯化反应、加聚反应制得 | |
| C. | 它在一定条件下发生水解反应时,可得到另外一种高分子化合物 | |
| D. | 等物质的量的有机玻璃和2-甲基丙烯酸甲酯耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com